Vanadocène
| Vanadocène | |
| |
| Identification | |
|---|---|
| Nom UICPA | vanadocène bis(η5-cyclopentadiényl)vanadium(II) |
| No CAS | |
| No ECHA | 100.149.756 |
| PubChem | 11984630 |
| Apparence | solide cristallin violet[1] |
| Propriétés chimiques | |
| Formule | C10H10V |
| Masse molaire[2] | 181,127 9 ± 0,008 8 g/mol C 66,31 %, H 5,56 %, V 28,12 %, |
| Propriétés physiques | |
| T° fusion | 165 à 167 °C[1] |
| T° ébullition | 200 °C (sublimation, 1 mmHg)[3] |
| Solubilité | se décompose dans l'eau[4] |
| Précautions | |
| SGH[1] | |
| H228, H301, H311, H315, H319, H331, H335, P210, P261, P280, P311, P301+P310 et P305+P351+P338 |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
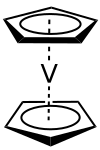
Le vanadocène ou bis(η5-cyclopentadiényl)vanadium(II) est un composé organométallique de formule V(C5H5)2,souvent abrégée en Cp2V. Il fait partie de la famille des composés composés sandwich et plus précisément de la sous-famille des métallocènes. Il se présente sous la forme d'un solide cristallin violet paramagnétique. Il ne possède que peu d'usages pratiques, mais a fait l'objet de nombreuses études.
Structure et propriétés[modifier | modifier le code]
Le vanadocène a la structure typique des métallocènes, c'est-à-dire qu'il est constitué d'un atome central métallique l'état d'oxydation +II (Va2+) pris en sandwich entre deux cycles de cyclopentadiényle (Cp) auquel il est lié par des liaisons haptiques Va-C d'une longueur moyenne de 226 pm[5]. Ce centre de vanadium(II) est équidistant des centroïdes de cycles Cp, localisé à un centre cristallographique d'inversion. À l'état solide la molécule a une symétrie D5d. Au-dessus de −103,15 °C, les cycles Cp du vanadocène sont perturbés dynamiquement et ne sont que parfaitement ordonnés en dessous de −165,15 °C.
L'énergie de dissociation des liaisons Cp–V est d'après la littérature comprise entre 145 kJ mol−1 et 369 kJ mol−1[6],[7].
Le vanadocène est un analogue du ferrocène mais n'en est pas un isoélectronique ; il ne respecte ainsi pas la règle des 18 électrons avec seulement 15 électrons de valence.
Synthèse[modifier | modifier le code]
Le vanadocène fut synthétisé la première fois par Birmingham, Fischer et Wilkinson par réduction du dichlorure de vanadocène par l'hydrure d'aluminium, puis le vanadocène est sublimé dans le vide à 100 °C[8].
En 1977, Köhler et al. sont parvenus à synthétiser le vanadocène par réaction entre le complexe de vanadium [V2Cl3(THF)6]2[Zn2Cl6] avec le cyclopentadiénure de sodium[9],[10] :
Cette méthode est toujours employée aujourd'hui et permet de produire de grandes quantités de vanadocène.
Le chlorure de vanadium(III) peut également être directement mis à réagir avec le cyclopentadiénure de sodium, mais il réagit alors également comme réducteur formant le sous-produit de couple de deux cycles Cp, le dihydrofulvalène[11] :
- 2 VCl3 + 6 Na(C5H5) → 2 V(C5H5)2 + 6 NaCl + H5C5-C5H5
Réactivité[modifier | modifier le code]
Le vanadocène est une molécule réactive. Il peut être facilement oxydé en monocation par réaction avec un sel de ferrocénium dans le toluène[12] :
- V(C5H5)2 + [Fe(C5H5)2][BR4] ⟶ [V(C5H5)2][BR4] + Fe(C5H5)2
où R est un groupe phényle ou le groupe 4-fluorophényle. Ces monocations sont extrêmement sensibles à l'air et ont un potentiel rédox de -1,10 V[12].
Du fait de ces 15 électrons de valence, le vanadocène réagit facilement avec d'autres ligands. Il peut par exemple réagir avec des dérivés acétyléniques, pour donner le complexe de cyclopropènevanadium correspondant :

Par échange de cycle réductif avec le n-butyllithium en présence de cyclohexa-1,3-diène, un de ses cycles de cyclopentadiène peut être remplacé par un cycle benzène[13] :
- V(C5H5)2 ⟶ V(C5H5)(C6H6).
Il réagit aussi avec le monoxyde de carbone, pour former un dérivé ionique du vanadocène, lorsque la réaction se fait en atmosphère inerte :
- Cp2V + V(CO)6 → [Cp2V(CO)2][V(CO)6]
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Vanadocene » (voir la liste des auteurs) et en allemand « Vanadocen » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Bis(cyclopentadienyl)vanadium(II), consultée le 20 novembre 2014.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Alfa Aesar, consultée le 20 novembre 2014
- L. Poirier, F Teyssandier, « Thermodynamics approach of the OMCVD of vanadum carbide form vanadocene », Electrochemical Society Proceding, vol. 96-5, , p. 757 (ISBN 978-1566771559)
- Robin D. Rogers, Jerry L. Atwood, Don Foust, and Marvin D. Rausch, « Crystal Structure of Vanadocene », Journal of Crystal and Molecular Structure, vol. 11, nos 5–6, , p. 183–188 (DOI 10.1007/BF01210393)
- Arnold F. Holleman, Egon Wiberg, Nils Wiberg, Lehrbuch der anorganischen Chemie, de Gruyter Verlag, , 1699–1703 p. (ISBN 3-11-012641-9)
- James E. Huheey, Ellen A. Keiter, Richard Keiter, Anorganische Chemie : Prinzipien von Struktur und Reaktivität, de Gruyter Verlag, , 1261 p. (ISBN 3-11-017903-2), p. 797
- Birmingham, J. M., A. K. Fischer, and G. Wilkinson, « The Reduction of Bis-cyclopentadienyl Compounds », Naturwissenschaften, vol. 42, no 4, , p. 96 (DOI 10.1007/BF00617242)
- (en) C. Lorber: "Vanadium Organometallics." Chapter 5.01. Comprehensive Organometallic Chemistry III. Elsevier, 2007. 1-60.
- (de) « Dissertation de Markus Jordan, Carl von Ossietzky Universität Oldenburg, 2009 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (PDF, 5,4 MB).
- (de) Integriertes Synthesepraktikum (ISP) Uni Hamburg: Vanadocen, (PDF, 58 kB).
- Calderazzo, Fausto, Isabella Ferri, Guido Pampaloni, and Ulli Englert, « Oxidation Products of Vanadocene and of Its Permethylated Analogue, Including the Isolation and the Reactivity of the Unsolvated [VCp]Cation », Organometallics, vol. 18, no 13, , p. 2452–2458 (DOI 10.1021/om9809320)
- Dissertation von Thomas Kupfer, Universität Würzburg, 2007 (PDF, 10,6 MB).



