Sulfate de zirconium
| Sulfate de zirconium(IV) | |
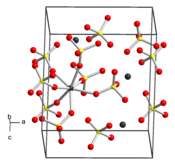
| |
| __ Zr __ S __ O Structure cristalline du sulfate de zirconium |
|
| Identification | |
|---|---|
| Nom systématique | sulfate de zirconium(IV) |
| Synonymes |
sulfate de zirconium |
| No CAS | (tétrahydrate) |
| No ECHA | 100.035.162 |
| No CE | 238-694-4 |
| PubChem | 26793 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche[1] |
| Propriétés chimiques | |
| Formule | O8S2Zr |
| Masse molaire[2] | 283,349 ± 0,014 g/mol O 45,17 %, S 22,63 %, Zr 32,19 %, |
| Propriétés physiques | |
| T° fusion | 410 °C[1] |
| Solubilité | 525 g/L[1] à 18 °C |
| Masse volumique | 3,22 g/cm3[1] |
| Précautions | |
| SGH[1] | |
| H315, H319, H335, P280, P312, P302+P352, P304+P340 et P305+P351+P338 |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sulfate de zirconium, ou sulfate de zirconium(IV), est un composé chimique de formule Zr(SO4)2·nH2O, où n = 0, 4, 5 ou 7 en fonction du degré d'hydratation[3]. Le tétrahydrate Zr(SO4)2·4H2O est la forme commerciale la plus courante. Il cristallise dans le système orthorhombique selon le groupe d'espace Fddd (no 70) avec les paramètres a = 1 162 pm, b = 2 592 pm et c = 5 532 pm. La forme anhydre est quant à elle microcristalline et très hygroscopique. Ces substances sont des solides blancs ou incolores, solubles dans l'eau, qui adoptent des structures cristallines complexes dans lesquelles les centres Zr(IV) présentent une coordinence de 7 à 8 avec des ligands à la fois sulfate SO42− et aqua H2O[3],[4]. Le sulfate de zirconium peut être utilisé comme intermédiaire dans la purification de sels de zirconium tels que le chlorure de zirconium(IV) ZrCl4 par recristallisation[5].
Le tétrahydrate peut être obtenu en faisant réagir du chlorure de zirconyle ZrOCl2 avec de l'acide sulfurique H2SO4. Si la teneur en SO3 dépasse 64 %, il se forme des sulfates acides tels que Zr(SO4)2·H2SO4·2H2O ou Zr(SO4)2·H2SO4·H2O. La substance anhydre est obtenue en traitant le tétrahydrate ou le chlorure de zirconyle avec de l'acide sulfurique concentré[5]. Elle se forme également par chauffage du tétrahydrate à 380 °C.
-
Échantillon de Zr(SO4)2·4H2O.
Notes et références[modifier | modifier le code]
- « Fiche du composé Zirconium(IV) sulfate tetrahydrate, 99.99% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) I. J. Bear et W. G. Mumme, « The crystal chemistry of zirconium sulphates. III. The structure of the β-pentahydrate, Zr2(SO4)4(H2O)8.2H2O, and the inter-relationship of the four higher hydrates », Acta Crystallographica Section B, vol. 25, , p. 1572-1581 (DOI 10.1107/S0567740869004341, lire en ligne).
- (en) Philip J. Squattrito, Philip R. Rudolf et Abraham Clearfield, « Crystal structure of a complex basic zirconium sulfate », Inorganic Chemistry, vol. 26, no 25, , p. 4240-4244 (DOI 10.1021/ic00272a020, lire en ligne).
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1376. (ISBN 3-432-87813-3)



