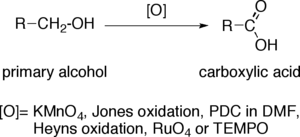
Oxydation des alcools primaires en acide carboxylique
L'oxydation des alcools primaires en acides carboxyliques est une réaction d'oxydation importante en chimie organique.
Lorsqu'un alcool primaire est converti en acide carboxylique, l'atome de carbone terminal augmente son état d'oxydation de quatre. Les oxydants capables d'effectuer cette opération dans des molécules organiques complexes, présentant d'autres groupes fonctionnels susceptibles d'être modifiés, doivent avoir une sélectivité importante. Les oxydants les plus utilisés sont le permanganate de potassium alcalin (KMnO4) ou le bichromate de potassium acidifié. Le PCC dans le DMF, le réactif de Jones, l'oxydation de Heyns, le tétroxyde de ruthénium (RuO4) et TEMPO font également partie des plus courants.
Le permanganate de potassium est un oxydant très puissant capable de réagir avec de multiples groupes fonctionnels, tels que les alcools secondaires, 1,2-diols, aldéhydes, alcènes, oximes, sulfures et thiols. Dans des conditions contrôlées, KMnO4 oxyde de façon efficace les alcools primaires en acides carboxyliques. Cette réaction, qui a d'abord été décrite en détail par Fournier[1],[2], est typiquement réalisée en introduisant du KMnO4 à une solution ou suspension de l'alcool dans une solution aqueuse alcaline. Le mélange résultant est agité jusqu'à ce que l'oxydation soit complète. Pour que la réaction se déroule efficacement, l'alcool doit être au moins partiellement dissous dans la solution aqueuse. Ceci peut être facilité par l'addition d'un solvant organique tel que le dioxane, la pyridine, l'acétone ou le tert-butanol (t-BuOH). Néanmoins, KMnO4 réagit préférentiellement avec une double liaison carbone-carbone avant d'oxyder un alcool primaire.
Habituellement, ces oxydations sont effectuées dans des conditions basiques fortes, car cela favorise une plus grande vitesse et sélectivité d'oxydation. Dans les substrats sensibles à une base forte, la réaction peut être effectuée à un pH plus bas - ou même dans des conditions acides - au prix d'une vitesse de réaction fortement diminuée.

KMnO4 est décomposé dans l'eau, entraînant la formation de dioxyde de manganèse (MnO2) et d'oxygène gazeux. Cette décomposition est catalysée par l'acide, la base et le MnO2. L'ampleur de cette décomposition étant difficile à estimer lors de l'oxydation des alcools primaires, la quantité de KMnO4 doit être ajustée lors de l'oxydation en l'ajoutant séquentiellement jusqu'à ce que l'oxydation soit complète.
Oxydation de Jones[modifier | modifier le code]
Le réactif dit « de Jones » est préparé en dissolvant du trioxyde de chrome (CrO3) dans de l'acide sulfurique (H2SO4) aqueux, ce qui conduit à la formation d'une solution rougeâtre contenant de l'acide chromique (H2CrO4) et des oligomères de celui-ci. L'addition de réactif de Jones à une solution d'alcool primaire dans l'acétone (comme décrit pour la première fois par Jones[4],[5]) entraîne l'oxydation de l'alcool en acide carboxylique. Ce protocole classique, impliquant une addition directe, est très souvent utilisé indépendamment du fait qu'il conduit fréquemment à la formation de quantités importantes d'esters (possédant la structure R-CO-O-CH2-R) issus de la dimérisation oxydative du primaire alcools. Holland et Gilman[6] ont prouvé que cette réaction secondaire peut être fortement réfrénée en suivant le protocole d'addition inverse par lequel une solution de l'alcool primaire dans l'acétone est lentement ajoutée au réactif de Jones dans des conditions aussi diluées que possible.
Le réactif de Jones interagit avec les alcools secondaires, ce qui entraîne une oxydation en cétones. Le traitement de composés, contenant à la fois des alcools primaires et secondaires, avec le réactif de Jones conduit à la formation d'acides céto.
Les problèmes rencontrés avec l’utilisation de grandes quantités de trioxyde de chrome, toxique et dangereux pour l’environnement, ont incité Zhao[7] a présenter un procédé catalytique, impliquant un traitement par excès d’acide périodique (H5IO6) en présence environ 1,2 % molaire de CrO3. La procédure de Zhao pour l'utilisation de CrO3 catalytique est très bien adaptée aux réactions à grande échelle[8].

Le dichromate de pyridinium (PDC) est un solide orange vif de formule (C5H5NH)2Cr2O7 qui est très souvent utilisé pour l'oxydation d'alcools primaires et secondaires respectivement en aldéhydes et cétones. D'autre part, en 1979, Corey et Schmidt ont rapporté[10] que la réaction d'alcools primaires saturés avec PDC, en utilisant le diméthylformamide (Me2NCHO, DMF) comme solvant, entraîne une oxydation en acides carboxyliques plutôt qu'en aldéhydes. Aucune oxydation en acides carboxyliques ne se produit sur les alcools primaires allyliques et benzyliques. La procédure de Corey et Schmidt pour l'oxydation d'alcools primaires saturés en acides carboxyliques se déroule dans des conditions essentiellement neutres.
Oxydation de Heyns[modifier | modifier le code]
Dans l'oxydation Heyns, le réactif oxydant est une combinaison d'oxygène et de platine.
Tétroxyde de ruthénium[modifier | modifier le code]
Le tétroxyde de ruthénium (RuO4) a de nombreuses utilisations en chimie organique en tant qu'agent oxydant. C'est un agent agressif permettant des conditions de réaction douces.
Oxydation en deux étapes des alcools en acides via des aldéhydes isolés[modifier | modifier le code]
Etant donné qu'un grand nombre des conditions susmentionnées pour les oxydations d'alcools primaires en acides sont dures et non compatibles avec les groupes protecteurs courants, les chimistes organiques utilisent souvent une procédure en deux étapes pour l'oxydation en acides. L'alcool primaire est oxydé en un aldéhyde en utilisant l'une des nombreuses procédures existantes (ex. : oxydation IBX, periodinane de Dess-Martin). L'aldéhyde peut ensuite être soumis aux conditions de l'oxydation de Pinnick à l'aide de chlorite de sodium[11]. Cette séquence est souvent utilisée dans la synthèse de produits naturels. Nicolaou et al. l'ont appliqué dans leur synthèse de Platencin[12].
Références[modifier | modifier le code]
- Fournier, H.M., « Transformation des alcools primaires saturès en acides monobasiques correspondants », Comptes Rendus Acad. Sci., , p. 331.
- H.M. Fournier, « Sur la préparation des acides gras et de leurs anhydres », Bulletin de la Société chimique de France, , p. 920 (lire en ligne).
- Ciufolini, M.A. et Swaminathan, S., « Synthesis of a model depsipeptide segment of Luzopeptins (BBM 928), potent antitumor and antiretroviral antibiotics », Tetrahedron Lett., vol. 30, no 23, , p. 3027 (DOI 10.1016/S0040-4039(00)99393-6).
- Heilbron, I., Jones, E.R.H. et Sondheimer, F., « 315. Researches on acetylenic compounds. Part XIV. A study of the reactions of the readily available ethynyl-ethylenic alcohol, pent-2-en-4-yn-1-ol », J. Chem. Soc., , p. 1586 (DOI 10.1039/jr9470001586).
- Heilbron, I. et Jones, E.R.H., « 129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols », J. Chem. Soc., , p. 604 (DOI 10.1039/jr9490000604).
- Holland, B.C. et Gilman, N.W., « An Improved Procedure for the Oxidation of Alkynols to Alkynoic Acids », Synth. Commun., vol. 4, no 4, , p. 203 (DOI 10.1080/00397917408062073).
- Zhao, M., Li, J., Song, Z. et Desmond, R., « A novel chromium trioxide catalyzed oxidation of primary alcohols to the carboxylic acids », Tetrahedron Lett., vol. 39, no 30, , p. 5323 (DOI 10.1016/S0040-4039(98)00987-3).
- Song, Z.J., Zhao, M., Desmond, R. et Devine, P., « Practical Asymmetric Synthesis of an Endothelin Receptor Antagonist », J. Org. Chem., vol. 64, no 26, , p. 9658 (DOI 10.1021/jo991292t).
- Crimmins, M.T. et DeBaillie, A.C., « Enantioselective Total Synthesis of Bistramide A », J. Am. Chem. Soc., vol. 128, no 15, , p. 4936–7 (PMID 16608311, PMCID 2546575, DOI 10.1021/ja057686l).
- Corey, E.J. et Schmidt, G., « Useful procedures for the oxidation of alcohols involving pyridinium dichromate in approtic media », Tetrahedron Lett., vol. 20, no 52, , p. 399 (DOI 10.1016/S0040-4039(01)93515-4).
- Bal B.S., Childers, Jr. W.E. et Pinnick H.W., « Oxidation of α,β-unsaturated aldehydes », Tetrahedron, vol. 37, no 11, , p. 2091 (DOI 10.1016/S0040-4020(01)97963-3).
- Nicolaou K.C., Scott Tria G. et Edmonds D. J., « Total Synthesis of Platencin », Angew. Chem., vol. 120, no 9, , p. 1804 (DOI 10.1002/ange.200800066).
Ouvrages[modifier | modifier le code]
- Marcos Fernández et Gabriel Tojo, Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis), Berlin, Springer, (ISBN 0-387-35431-X)

