Octocrylène
| Octocrylène | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-cyano-3,3-diphénylacrylate de 2-éthylhexyle | |
| Nom systématique | (RS)-2-cyano-3,3-diphénylprop-2-énoate de 2-éthylhexyle | |
| Synonymes |
Octocrylène |
|
| No CAS | ||
| No ECHA | 100.025.683 | |
| No CE | 228-250-8 | |
| PubChem | 22571 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide visqueux jaune[1] | |
| Propriétés chimiques | ||
| Formule | C24H27NO2 |
|
| Masse molaire[2] | 361,476 7 ± 0,021 9 g/mol C 79,74 %, H 7,53 %, N 3,87 %, O 8,85 %, |
|
| Propriétés physiques | ||
| T° fusion | −10 °C[1] | |
| T° ébullition | 218 °C (2 hPa)[1] | |
| Solubilité | 0,001 3 g l−1 (eau, (20 °C)[1] | |
| Masse volumique | 1,051 g cm−3[1] | |
| T° d'auto-inflammation | 401 °C (1,006 à 1,023 hPa)[1] | |
| Point d’éclair | 234 °C (coupelle fermée)[1] | |
| Pression de vapeur saturante | 0,3 hPa (179 °C)[1] | |
| Viscosité dynamique | 4,254 mPa s (20 °C)[1] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,567[1] | |
| Précautions | ||
| SGH | ||
| H413, P273 et P501 [1] |
||
| Écotoxicologie | ||
| DL50 | > 5,000 mg/kg (rat, oral) 2,000 mg/kg (rat, dermique)[1] |
|
| LogP | 6,1 (23 °C)[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'octocrylène est un composé organique utilisé comme principe actif dans les crèmes solaires et les cosmétiques.
Propriétés[modifier | modifier le code]
L'octocrylène se présente sous la forme d'un liquide visqueux, gras et jaune à incolore. Chimiquement, c'est l'ester formé par la réaction du 3,3-diphénylcyanoacrylate avec le 2-éthylhexanol, et il possède les éléments structuraux des cyanoacrylates et des esters de l'acide cinnamique. La molécule possède un carbone asymétrique, le carbone 2 du groupe hexyle auquel est rattaché le groupe éthyle et existe donc sous la forme d'un racémique RS.
La conjugaison étendue de la partie acrylate de la molécule absorbe les rayons ultraviolets avec des longueurs d'onde de 280 à 320 nm[3] avec un maximum à 303 nm[4], donc essentiellement les UV-B et dans une moindre mesure les UV-A. C'est notamment cette partie qui peut servir de filtre UV pour protéger la peau des atteintes directes de l'ADN (en). La partie éthylhexanol est un alcool gras, conférant des propriétés émollientes et hydrophobes.
La protection offerte par le seul octocrylène n'est pas très forte, et il est donc toujours utilisé en combinaison avec d'autres substances filtrantes, en particulier des filtres UV-A, dont il augmente la photostabilité, par exemple l'avobenzone dont il augmente et stabilise l'effet protecteur[5],[6].
L'ajout de nanoparticules de dioxyde de titane, un absorbeur d'UV inorganique, à de tels mélanges peut être contre-productif car les nanoparticules de TiO2 non enrobées sont hautement photoréactives, ce qui peut résulter en la formation de dérivés réactifs de l'oxygène (DRO) qui augmente la photodégradation des absorbeurs organiques, annulant ainsi leur effet protecteur[7].
Après l'application sur la peau, l'octocrylène supprime une éventuelle recristallisation des substances dissoutes des filtres UV. L'octocrylène lui-même est photostable et peu irritant à l'usage[8].
L'octocrylène, comme d'autres composés similaires tels que le méthoxycinnamate d'octyle (en) ou l'oxybenzone (benzophénone-3), également utilisés comme filtre UV lorsqu'appliqués sur la peau, peuvent pénétrer la peau où ils agissent alors comme photosensibilisateurs. Cela se traduit par une production accrue de DRO sous rayonnement solaire[9].
Synthèse[modifier | modifier le code]
L'octocrylène (3) peut être obtenu par condensation de Knoevenagel de la benzophénone (1) sur le cyanocétate de 2-éthylhexyle (2) (obtenu par estérification du 2-éthylhexanol par l'acide cyanoacétique (en) en présence d'APTS, avec un rendement de 92 %[10]). Le mélange est chauffé à 100 °C en présence d'acide propanoïque et d'acétate d'ammonium pendant 5 à 6 heures, pour un rendement compris entre 79 et 94 %[11].
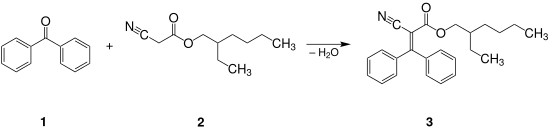
Dans de telles conditions (température, temps), des sous-produits indésirables tels que le 2-cyano-3,3-diphénylacrylamide sont produits, et il n'y a pas conversion complète des réactifs qui sont donc toujours présents dans le mélange réactionnel. Ce dernier point pose particulièrement problème étant donné que l'octocrylène est principalement utilisé comme filtre UV dans les crèmes solaires et que la benzophénone a des propriétés photosensibilisantes ; il est donc nécessaire d'éliminer toute trace de cette dernière du produit final.
Alternativement, il est possible de faire réagir le cyanoacétate d'éthyle avec la benzophénone[12] :

La réaction de Knoevenagel avec de l'acide acétique glacial et de l'ammoniac gazeux nécessite de longs temps de réaction (> 48 heures) pour une conversion élevée (>95 %) afin d'atteindre des rendements de produit final utilisables industriellement (90 %). Le 2-cyano-3,3-diphénylacrylate d'éthyle obtenu est ensuite transestérifié en présence de carbonate de sodium avec le 2-éthylhexanol, donnant l'octocrilène avec un rendement de 97 %[13].

Une variante existe avec comme réactif initial la benzophénone-imine (en) (1,1-diphénylméthanimine) qui n'a pas l'inconvénient des faibles taux de conversion ou de contamination du produit final par la benzophénone. La benzophénone-imine est produite par réaction de la benzophénone avec de l'ammoniac en présence de dioxyde de titane, le mélange étant chauffé à 130 °C sous une pression de 200 bar. Cette réaction a une sélectivité allant jusqu'à 99 % et un taux conversion jusqu'à 98 %[14]. Une fois obtenu, la benzophénone-imine est mise à réagir avec du cyanoacétate de 2-éthylhexyle à température ambiante[15]. Après distillation sous vide dans un évaporateur à couche mince (de), l'octocrilène est obtenu sous la forme d'une huile jaune clair avec un rendement de 94 % et une pureté de 99,5 %.

Dégradation et risques environnementaux[modifier | modifier le code]
Une étude de 2021 révèle qu'au cours du temps, l'octocrylène se dégrade en benzophénone, un composé cancérogène, photomutagène et perturbateur endocrinien, dans les produits du commerce[16],[17].
Il a été observé que l'octocrylène s'accumule dans les coraux, sous forme de conjugués d'acides gras, et déclenche un dysfonctionnement mitochondrial[18]. En outre, il a été démontré que l'octocrylène traverse la peau dans des expériences humaines, pénètre dans la circulation sanguine, est métabolisé et finalement excrété dans l'urine sous la forme de ses métabolites[19],[20]. Les Palaos ont interdit la vente et l'utilisation de trois filtres UV toxiques pour les récifs, dont l'octocrylène, dans sa loi de 2018 sur l'éducation au tourisme responsable[21]. En 2019, les îles Vierges américaines ont également interdit la vente et l'utilisation d'oxybenzone, d'octinoxate (en) et d'octocrylène. En 2023, l'Anses transmet au gouvernement français une demande de restriction de l'usage d'octocrylène du fait de ses effets sur l'environnement[22].
Notes et références[modifier | modifier le code]
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Octocrylene » (voir la liste des auteurs) et en allemand « Octocrilen » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé 2-Éthylhexyl 2-cyano-3,3-diphénylacrylate, consultée le 10 juillet 2023.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Smart Skin Care: Octocrylene
- Nadim A. Shaath, « SPF Boosters & Photostability of Ultraviolet Filters », sur happi.com, (consulté le ).
- (de) « UV-Filtersubstanzen in Sonnenschutzmitteln », sur Bundesinstitut für Risikobewertung, Déclaration du BfR (Bundesinstitut für Risikobewertung - Institut fédéral d'évaluation des risques) du 6 août 2003 concernant les filtre UV dans les crème solaires.
- (de) Sindy Trauer, « Sonnenschutz – Manchmal trügt der Schein », Pharmazeutische Zeitung, vol. 22, (lire en ligne).
- J. Kockler, M. Oelgemüller, S. Robertson et B.D. Glass, « Influence of Titanium Dioxide Particle Size on the Photostability of the Chemical UV-Filters Butyl Methoxy Dibenzoylmethane and Octocrylene in a Microemulsion », Cosmetics, vol. 1, , p. 128–139 (DOI 10.3390/cosmetics1020128).
- A. Bennàssar et al., « Two cases of photocontact allergy to the new sun filter octocrylene », Dermatology Online Journal, vol. 15, no 12, (DOI 10.5070/D37n3786c4).
- Hanson Kerry M., Gratton Enrico et Bardeen Christopher J., « Sunscreen enhancement of UV-induced reactive oxygen species in the skin », Free Radical Biology and Medicine, vol. 41, no 8, , p. 1205–1212 (PMID 17015167, DOI 10.1016/j.freeradbiomed.2006.06.011, lire en ligne).
- Brevet WO 2008089920 Process for the manufacture of substituted 2-cyano cinnamic esters, J. Huang, S. Jing, R. Karge, et R. Proplesch pour DSM IP Assets B.V.
- Brevet US 5451694 Process for preparing substituted 2-cyanocinnamic esters, W. Kuhn, W. Marks, T. Thielmann et E. Dilk pour Haarmann & Reimer GmbH.
- Brevet US 3149148 Process for condensation reactions, M. Kladko, M.M. Lee pour General Aniline & Film Corp.
- Brevet US 5047571 Process for the preparation of 2-cyano-3,3-diarylacrylates, P. Spang, P. Neumann pour BASF AG.
- Preparation of benzophenone imines, G. Voit, M. Holderbaum, T. Witzel, A. Aumüller pour BASF AG Brevet US 5679855Preparation of benzophenone imines, G. Voit, M. Holderbaum, T. Witzel, A. Aumüller pour BASF AG .
- Brevet US 5917080 Preparation of 2-cyano-3,3-diarylacrylic esters, M. Holderbaum, K. Beck, A. Aumüller, T. Witzel et G. Voit pour BASF AG.
- Centre national de recherche scientifique, « Un filtre présent dans de nombreuses crèmes solaires se transforme en un composé cancérigène » [PDF], sur cnrs.fr (consulté le ).
- (en) C.A. Downs et al., « Benzophenone Accumulates over Time from the Degradation of Octocrylene in Commercial Sunscreen Products », Chemical Research in Toxicology, (DOI 10.1021/acs.chemrestox.0c00461, lire en ligne, consulté le ).
- Didier Stien, Fanny Clergeaud, Alice M.S. Rodrigues, Karine Lebaron, Rémi Pillot, Pascal Romans, Sonja Fagervold et Philippe Lebaron, « Metabolomics reveal that octocrylene accumulates in Pocillopora damicornis tissues as fatty acid conjugates and triggers coral cell mitochondrial dysfunction », Analytical Chemistry, vol. 91, no 1, , p. 990–995 (PMID 30516955, DOI 10.1021/acs.analchem.8b04187, lire en ligne).
- Daniel Bury, Vladimir N. Belov, Yulin Qi, Heiko Hayen, Dietrich A. Volmer, Thomas Brüning et Holger M. Koch, « Determination of urinary metabolites of the emerging UV filter octocrylene by online-SPE-LC-MS/MS », Analytical Chemistry, vol. 90, no 1, , p. 944–951 (PMID 29188988, DOI 10.1021/acs.analchem.7b03996, hdl 21.11116/0000-0000-3212-3
 ).
).
- Daniel Bury, Hendrik Modick-Biermann, Edgar Leibold, Thomas Brüning et Holger M. Koch, « Urinary metabolites of the UV filter octocrylene in humans as biomarkers of exposure », Archives of Toxicology, vol. 93, no 5, , p. 1227–1238 (PMID 30739143, DOI 10.1007/s00204-019-02408-7, S2CID 59622082).
- Republic of Palau, « Your guide to finding and using Palau National Government services », sur PalauGov.pw (consulté le ).
- Marie Dupin, « Crèmes solaires : l'Anses demande le retrait de l'octocrylène à cause de ses effets sur l'environnement », sur francetvinfo.fr, (consulté le ).

