« Métallocène » : différence entre les versions
Rédaction. |
Rédaction. |
||
| Ligne 1 : | Ligne 1 : | ||
Les '''métallocènes''' sont des [[Complexe (chimie)|complexes]] [[chimie organométallique|organométalliques]] de type [[Composé sandwich|sandwich]] ayant pour [[Formule chimique|formule]] générale {{nobr|{{fchim|(''η''{{5}}-C|5|H|5|)|2|M{{Gris|{{exp|{{II}}}}}}}}}}, souvent écrite {{fchim|M(C|5|H|5|)|2}}, où {{nobr|M{{Gris|{{exp|{{II}}}}}}}} est un [[Élément chimique|élément]] [[métal]]lique à l'[[état d'oxydation]] +2 entre deux [[Ligand (chimie)|ligands]] [[cyclopentadiényle]] {{nobr|(''η''{{5}}-{{fchim|C|5|H|5}})}} parallèles<ref>{{GoldBook|title= |
Les '''métallocènes''' sont des [[Complexe (chimie)|complexes]] [[chimie organométallique|organométalliques]] de type [[Composé sandwich|sandwich]] ayant pour [[Formule chimique|formule]] générale {{nobr|{{fchim|(''η''{{5}}-C|5|H|5|)|2|M{{Gris|{{exp|{{II}}}}}}}}}}, souvent écrite {{fchim|M(C|5|H|5|)|2}}, où {{nobr|M{{Gris|{{exp|{{II}}}}}}}} est un [[Élément chimique|élément]] [[métal]]lique à l'[[état d'oxydation]] +2 entre deux [[Ligand (chimie)|ligands]] [[cyclopentadiényle]] {{nobr|(''η''{{5}}-{{fchim|C|5|H|5}})}} parallèles<ref name="GoldBook">{{GoldBook|title=metallocenes|url=https://goldbook.iupac.org/terms/view/M03865}}</ref>. La notation « ''η''{{5}} » indique que l'atome de métal est lié par une [[Hapticité|liaison haptique]] aux cinq atomes de carbone de chaque [[Composé cyclique|cycle]] cyclopendadiényle. Ces derniers sont généralement abrégés « Cp », de sorte que les métallocènes s'écrivent fréquemment {{fchim|Cp|2|M}}. Le [[ferrocène]] {{fchim|Fe(C|5|H|5|)|2}} est le représentant typique de cette famille de composés, dont la découverte en 1951 constitue un jalon important de l'histoire de la [[chimie organométallique]]. |
||
Au-delà de cette définition initiale restrictive sont également considérés comme ''métallocènes'' des composés sandwich dont les ligands cyclopentadiényle ne sont pas liés tous les deux à l'atome métallique par une liaison pentahapto {{nobr|''η''{{5}}}} ou ne sont pas coplanaires, des {{Lien|langue=en|trad=Coordination polymer|fr=Polymère de coordination|texte=polymères}} de sandwiches métalliques de cyclopentadiényles, voire des composés « demi-sandwich » de cyclopentadiényle, également dits [[Complexe en tabouret de piano|en tabouret de piano]], et des [[dimère]]s de tels composés. On estime que plus de 80 % des complexes organométalliques connus sont des complexes métalliques de cyclopentadiényle<ref name="Römpp">{{de}} entrée « ''{{lang|de|Cyclopentadienyl}}'' » sur la [[Römpp Lexikon Chemie]] en ligne.</ref>. |
Au-delà de cette définition initiale restrictive sont également considérés comme ''métallocènes'' des composés sandwich dont les ligands cyclopentadiényle ne sont pas liés tous les deux à l'atome métallique par une liaison pentahapto {{nobr|''η''{{5}}}} ou ne sont pas coplanaires, des {{Lien|langue=en|trad=Coordination polymer|fr=Polymère de coordination|texte=polymères}} de sandwiches métalliques de cyclopentadiényles, voire des composés « demi-sandwich » de cyclopentadiényle, également dits [[Complexe en tabouret de piano|en tabouret de piano]], et des [[dimère]]s de tels composés. Par extension, on assimile aux métallocènes les [[actinocène]]s {{nobr|{{fchim|(''η''{{8}}-C|8|H|8|)|2|[[Actinide|An]]{{Gris|{{exp|{{IV}}}}}}}}}}, composés sandwich d'[[actinide]]s à l'[[état d'oxydation]] +4 et de [[Anion cyclooctatétraénure|dianions cyclooctatétraénure]] {{nobr|[{{fchim|C|8|H|8}}]{{exp|2–}}}}, tels que l'[[uranocène]] {{nobr|{{fchim|(''η''{{8}}-C|8|H|8|)|2|[[Uranium|U]]}}}} et le [[plutonocène]] {{nobr|{{fchim|(''η''{{8}}-C|8|H|8|)|2|[[Plutonium|Pu]]}}}}. On estime que plus de 80 % des complexes organométalliques connus sont des complexes métalliques de cyclopentadiényle<ref name="Römpp">{{de}} entrée « ''{{lang|de|Cyclopentadienyl}}'' » sur la [[Römpp Lexikon Chemie]] en ligne.</ref>. |
||
<gallery mode="packed" heights="110px" caption="Exemples de métallocènes."> |
<gallery mode="packed" heights="110px" caption="Exemples de métallocènes."> |
||
| Ligne 8 : | Ligne 8 : | ||
Fichier:Stannocene.png|{{Centrer|[[Stannocène]] {{fchim|Cp|2|[[Étain|Sn]]}}.}} |
Fichier:Stannocene.png|{{Centrer|[[Stannocène]] {{fchim|Cp|2|[[Étain|Sn]]}}.}} |
||
</gallery> |
</gallery> |
||
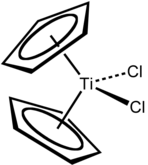
Les métallocènes ont de nombreuses utilisations. Ils sont utilisés pour fabriquer des [[Diode électroluminescente|diodes électroluminescentes]]. Les dérivés de métallocènes tels que le [[dichlorure de titanocène]] {{fchim|Cp|2|TiCl|2}} sont utiles comme [[catalyse]]urs pour la [[polymérisation]] d'[[alcène]]s avec un [[Rendement chimique|rendement]] et une [[Sélectivité (chimie)|sélectivité]] élevés. Les dérivés [[cation]]iques de métallocènes du [[Groupe 4 du tableau périodique|groupe 4]] de type {{nobr|[{{fchim|Cp|2|ZrCH|3}}]{{exp|+}}}} sont ainsi des [[Catalyseur Ziegler-Natta|catalyseurs Ziegler-Natta]]. En [[cancérologie]], certains dérivés de métallocènes, tels que les dichlorures [[Dichlorure de titanocène|de titanocène]], [[Dichlorure de niobocène|de niobocène]], [[Dichlorure de molybdocène|de molybdocène]] et de [[rhénocène]] présentent des propriétés [[cytostatique]]s. Par ailleurs, le ferrocène {{fchim|Cp|2|Fe}} et le [[(Méthylcyclopentadiényl)manganèse tricarbonyle|MMT]] {{fchim|MeCpMn(CO)|3}} peut être utilisé pour augmenter l'[[indice d'octane]] des carburants (en remplacement du [[Tétraéthylplomb|plomb tétraéthyle]] {{fchim|PbEt|4}}) et pour améliorer leur combustion. |
|||
En 1973, le chimiste allemand [[Ernst Otto Fischer]] et le chimiste britannique [[Geoffrey Wilkinson]] reçurent le [[prix Nobel de chimie]] pour leurs travaux sur les composés organométalliques de type sandwich et l'élucidation de la liaison dans le ferrocène<ref name="Nobel"> |
|||
{{Lien web |
|||
| langue = en |
|||
| url = https://www.nobelprize.org/prizes/chemistry/1973/press-release/ |
|||
| titre = The Nobel Prize in Chemistry 1973 |
|||
| date = 23 octobre 1973 |
|||
| site = https://www.nobelprize.org/ |
|||
| consulté le = 28 juin 2022 |
|||
}}.</ref>. |
|||
== Présentation générale == |
== Présentation générale == |
||
| Ligne 350 : | Ligne 362 : | ||
}}</ref>, et le [[plutonocène]] {{nobr|{{fchim|(''η''{{8}}-C|8|H|8|)|2|[[Plutonium|Pu]]}}}}<ref name="10.1021/ja00719a014"/>. |
}}</ref>, et le [[plutonocène]] {{nobr|{{fchim|(''η''{{8}}-C|8|H|8|)|2|[[Plutonium|Pu]]}}}}<ref name="10.1021/ja00719a014"/>. |
||
== Applications == |
|||
Des métallocènes pliés entrent dans la préparation de [[Catalyse|catalyseurs]] permettant de fabriquer par [[polymérisation coordinative]] des [[polymère]]s ayant des propriétés très prometteuses : |
|||
* [[polyéthylène]] de très haute masse molaire ({{unité/2|≈ 6{{x10|6}}|g||mol|-1}}), désigné par le sigle UHMWPE en anglais, meilleur que le ''[[Kevlar]]'' (composant des [[Gilet pare-balles|gilets pare-balles]], par exemple) ; |
|||
=== Comme catalyseurs de polymérisation des alcènes === |
|||
* [[plastomère]]s ; |
|||
* polymères possédant de très fortes [[tacticité]]s (polymères isotactiques et syndiotactiques, selon les besoins) tels les [[polypropylène]]s PPi et PPs. |
|||
L'application de loin la plus importante des métallocènes et de leurs dérivés est leur utilisation comme [[catalyse]]urs de [[polymérisation]] des [[alcène]]s pour la production de [[polyoléfine]]s<ref name="10.1002/ciuz.19940280410"> |
|||
Grâce à leur rendement très élevé, les métallocènes constituent des systèmes catalytiques d’avenir. |
|||
{{Article |
|||
| langue = de |
|||
| nom1 = Michael Aulbach et Frank Küber |
|||
| titre = Metallocene – maßgeschneiderte Werkzeuge zur Herstellung von Polyolefinen |
|||
| périodique = Chemie in unserer Zeit |
|||
| volume = 28 |
|||
| numéro = 4 |
|||
| jour = |
|||
| mois = août |
|||
| année = 1994 |
|||
| pages = 197-208 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/ciuz.19940280410 |
|||
| consulté le = 28 juin 2022 |
|||
| doi = 10.1002/ciuz.19940280410 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. |
|||
Les [[Catalyseur Ziegler-Natta|catalyseurs Ziegler-Natta]] sont utilisés pour polymériser des alcènes tels que l'[[éthylène]] {{fchim|CH|2|{{=}}CH|2}} ou le [[propylène]] {{fchim|CH|2|{{=}}CHCH|3}} à basse pression et température depuis les [[années 1950]]. Dans un mécanisme d'addition-insertion en plusieurs étapes, l'alcène est d'abord lié à un [[Complexe (chimie)|complexe]] [[Composé organotitane|organotitane]] puis incorporée dans la [[Liaison chimique|liaison]] {{nobr|[[titane]]–[[carbone]]}}. L'alcène suivant est ensuite lié au site de coordination qui est libéré dans le processus, et la réaction en chaîne se poursuit par l'incorporation de l'alcène dans la liaison {{nobr|titane–carbone}}. Les catalyseurs Ziegler-Natta classiques sont des catalyseurs mixtes constitués d'un [[composé organométallique]] du [[Groupe 1 du tableau périodique|{{nobr|groupe 1}}]], du [[Groupe 2 du tableau périodique|{{nobr|groupe 2}}]] ou [[Groupe 13 du tableau périodique|{{nobr|groupe 13}}]] (par exemple le [[triéthylaluminium]]) dans le [[groupe principal]] et d'un composé de [[métal de transition]], principalement du [[Groupe 4 du tableau périodique|{{nobr|groupe 4}}]], du [[Groupe 5 du tableau périodique|{{nobr|groupe 5}}]] ou du [[Groupe 6 du tableau périodique|{{nobr|groupe 6}}]] (par exemple le [[tétrachlorure de titane]]) parmi les [[Métal de transition|métaux de transition]]. Cependant, ils présentent l'inconvénient décisif d'être généralement utilisés comme [[Catalyse hétérogène|catalyseurs hétérogènes]] sur un matériau support, car ils ne sont pas solubles dans les [[Solvant organique|solvants organiques]]. Par conséquent, en plus des propriétés réelles du catalyseur, les propriétés du matériau de support, la vitesse de diffusion de l'alcène et d'autres réactions d'[[adsorption]] jouent également un rôle. |
|||
En 1980, Hansjörg Sinn et [[Walter Kaminsky]] ont décrit les réactions de polymérisation catalytique de mélanges de di[[halogénure]]s de métallocènes (type 1 ci-dessous) avec du [[méthylaluminoxane]] (MAO). Ces [[Catalyseur de Kaminsky|catalyseurs de Kaminsky]] permettent la polymérisation de mélanges d'[[éthylène]], de [[propylène]] ou d'[[alcène]]s avec un [[Rendement chimique|rendement]] et une [[Sélectivité (chimie)|sélectivité]] très élevées<ref name="10.1002/anie.198003901"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Hansjörg Sinn, Walter Kaminsky, Hans-Jürgen Vollmer et Rüdiger Woldt |
|||
| titre = “Living Polymers” on Polymerization with Extremely Productive Ziegler Catalysts |
|||
| périodique = Angewandte Chemie International Edition |
|||
| volume = 19 |
|||
| numéro = 5 |
|||
| jour = |
|||
| mois = mai |
|||
| année = 1980 |
|||
| pages = 390-392 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/anie.198003901 |
|||
| consulté le = 28 juin 2022 |
|||
| doi = 10.1002/anie.198003901 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. Alors que les métallocènes ne montrent qu'une faible activité avec un cocatalyseur [[Alkyle|alkyl]][[aluminium]] conventionnel, la présence d'un excès de méthylaluminoxane augmente leur réactivité d'un facteur {{nb|10000}} ou plus, ce qui les rend cent fois plus actifs qu'un catalyseur Ziegler-Natta traditionnel. Les catalyseurs de Kaminsky sont également solubles dans les [[hydrocarbure]]s et, contrairement aux catalyseurs Ziegler-Natta, peuvent donc être utilisés directement en solution<ref name="10.1002/14356007.b16_b36.pub2"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Walter Kaminsky |
|||
| titre = Metallocenes |
|||
| périodique = Ullmann's Encyclopedia of Industrial Chemistry |
|||
| volume = |
|||
| numéro = |
|||
| jour = 15 |
|||
| mois = juillet |
|||
| année = 2006 |
|||
| pages = |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/14356007.b16_b36.pub2 |
|||
| consulté le = 28 juin 2022 |
|||
| doi = 10.1002/14356007.b16_b36.pub2 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. Avec les catalyseurs Kaminsky à base de [[zirconocène]], jusqu'à {{unité|100|tonnes}} d'éthylène par gramme de [[zirconium]] peuvent être polymérisées avec un temps d'insertion de l'ordre de {{unité|e-5|s}}<ref name="10.1002/14356007.b16_b36.pub2"/>. |
|||
<gallery mode="packed" heights="185px"> |
|||
Fichier:Metallocenes3.png|{{Centrer|L'utilisation de [[métallocène]]s ('''1''') pour la [[polymérisation]] du [[propylène]] donne du [[polypropylène]] [[atactique]], tandis que les systèmes catalytiques à base de métallocènes à [[Indène|indényles]] pontés de [[Symétrie moléculaire|symétrie]] {{nobr|''C''{{ind|2}}}} ('''2''') ou à [[Fluorène|fluorényl]]-[[cyclopentadiényle]] pontés de symétrie {{nobr|''C''{{ind|s}}}} ('''3''') produisent des [[polymère]]s respectivement [[isotactique]]s et [[syndiotactique]]s.}} |
|||
</gallery> |
|||
Cinq ans plus tard, Walter Kaminsky et Hans-Herbert Brintzinger ont rapporté qu'en utilisant des {{Lien|langue=en|trad=Ansa-metallocene|fr=ansa-Métallocène|texte=''ansa''-métallocènes}} de type 2 (''ansa''-métallocènes à [[Symétrie moléculaire|symétrie]] {{nobr|''C''{{ind|2}}}}), il est possible d'obtenir du [[polypropylène]] ayant un arrangement strictement [[isotactique]]. En augmentant la taille des résidus organiques sur les cycles Cp (comme dans le type 3) et/ou en faisant varier les atomes de pontage, l'activité et la sélectivité peuvent être spécifiquement modulées et la distribution de la [[masse moléculaire]] des polymères résultants peut être optimisée dans des limites étroites<ref name="10.1002/ciuz.19940280410"/>{{,}}<ref name="10.1002/14356007.b16_b36.pub2"/>. |
|||
Le [[magnésocène]] ainsi que le bis(cyclopentadiényl)calcium et le bis(cyclopentadiényl)strontium peuvent également être utilisés comme catalyseurs de polymérisation, par exemple pour le [[méthacrylate de méthyle]] (MMA)<ref name="10.1021/om030452v"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Aibing Xia, John E. Knox, Mary Jane Heeg, H. Bernhard Schlegel et Charles H. Winter |
|||
| titre = Synthesis, Structure, and Properties of Magnesocene Amine Adducts. Structural Distortions Arising from N−H···{{fchim|C|5|H|5}}{{exp|-}} Hydrogen Bonding and Molecular Orbital Calculations Thereof |
|||
| périodique = Organometallics |
|||
| volume = 22 |
|||
| numéro = 20 |
|||
| jour = 23 |
|||
| mois = août |
|||
| année = 2003 |
|||
| pages = 4060-4069 |
|||
| url texte = https://pubs.acs.org/doi/abs/10.1021/om030452v |
|||
| consulté le = 28 juin 2022 |
|||
| doi = 10.1021/om030452v |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. |
|||
== Notes et références == |
== Notes et références == |
||
{{Références}} |
{{Références nombreuses|taille=30}} |
||
{{Palette|Chimie organométallique|Matériaux polymères}} |
{{Palette|Chimie organométallique|Matériaux polymères}} |
||
Version du 28 juin 2022 à 23:00
Les métallocènes sont des complexes organométalliques de type sandwich ayant pour formule générale (η5-C5H5)2MII, souvent écrite M(C5H5)2, où MII est un élément métallique à l'état d'oxydation +2 entre deux ligands cyclopentadiényle (η5-C5H5) parallèles[1]. La notation « η5 » indique que l'atome de métal est lié par une liaison haptique aux cinq atomes de carbone de chaque cycle cyclopendadiényle. Ces derniers sont généralement abrégés « Cp », de sorte que les métallocènes s'écrivent fréquemment Cp2M. Le ferrocène Fe(C5H5)2 est le représentant typique de cette famille de composés, dont la découverte en 1951 constitue un jalon important de l'histoire de la chimie organométallique.
Au-delà de cette définition initiale restrictive sont également considérés comme métallocènes des composés sandwich dont les ligands cyclopentadiényle ne sont pas liés tous les deux à l'atome métallique par une liaison pentahapto η5 ou ne sont pas coplanaires, des polymères (en) de sandwiches métalliques de cyclopentadiényles, voire des composés « demi-sandwich » de cyclopentadiényle, également dits en tabouret de piano, et des dimères de tels composés. Par extension, on assimile aux métallocènes les actinocènes (η8-C8H8)2AnIV, composés sandwich d'actinides à l'état d'oxydation +4 et de dianions cyclooctatétraénure [C8H8]2–, tels que l'uranocène (η8-C8H8)2U et le plutonocène (η8-C8H8)2Pu. On estime que plus de 80 % des complexes organométalliques connus sont des complexes métalliques de cyclopentadiényle[2].
- Exemples de métallocènes.
-
-
Béryllocène η1, η5-Cp2Be.
-
Stannocène Cp2Sn.
Les métallocènes ont de nombreuses utilisations. Ils sont utilisés pour fabriquer des diodes électroluminescentes. Les dérivés de métallocènes tels que le dichlorure de titanocène Cp2TiCl2 sont utiles comme catalyseurs pour la polymérisation d'alcènes avec un rendement et une sélectivité élevés. Les dérivés cationiques de métallocènes du groupe 4 de type [Cp2ZrCH3]+ sont ainsi des catalyseurs Ziegler-Natta. En cancérologie, certains dérivés de métallocènes, tels que les dichlorures de titanocène, de niobocène, de molybdocène et de rhénocène présentent des propriétés cytostatiques. Par ailleurs, le ferrocène Cp2Fe et le MMT MeCpMn(CO)3 peut être utilisé pour augmenter l'indice d'octane des carburants (en remplacement du plomb tétraéthyle PbEt4) et pour améliorer leur combustion.
En 1973, le chimiste allemand Ernst Otto Fischer et le chimiste britannique Geoffrey Wilkinson reçurent le prix Nobel de chimie pour leurs travaux sur les composés organométalliques de type sandwich et l'élucidation de la liaison dans le ferrocène[3].
Présentation générale
La plupart des métallocènes sont à base de métaux de transition. Le ferrocène (η5-C5H5)2Fe est ainsi le premier d'entre eux à avoir été caractérisé, en 1951[4], puis des métallocènes ont été produits avec une série d'autres métaux de transition, comme le nickelocène (η5-C5H5)2Ni[5], le cobaltocène (η5-C5H5)2Co[6], le chromocène (η5-C5H5)2Cr[7], le vanadocène (η5-C5H5)2V[8], le rhodocène (η5-C5H5)2Rh[9], le ruthénocène (η5-C5H5)2Ru[10], l'osmocène (η5-C5H5)2Os[11] ou encore le rhénocène (η5-C5H5)2Re[12]. Certains métallocènes sont à base de métaux alcalino-terreux, comme le magnésocène (η5-C5H5)2Mg[13], ou de métaux pauvres, comme le plombocène (η5-C5H5)2Pb[14]. Le béryllocène (η1-C5H5)(η5-C5H5)Be[15] se distingue par le glissement d'un ligand cyclopentadiényle par rapport à l'autre, avec une configuration qui tend vers (η3-C5H5)(η5-C5H5)Be en phase gazeuse[16].
-
Modes de liaisons haptiques métal–Cp.
Les cycles cyclopentadiényle ne sont pas parallèles dans le stannocène (η5-C5H5)2Sn[17], tandis que le manganocène [(η5-C5H5)2Mn]n est polymérique[18]. Certains, comme le zirconocène (η5-C5H5)2Zr[19], nécessitent des ligands stabilisateurs pour exister, donnant par exemple le dichlorure de zirconocène (η5-C5H5)2ZrCl2[20], le dichlorure de titanocène (η5-C5H5)2TiCl2[20] et le dichlorure d'hafnocène (η5-C5H5)2HfCl2[21], dans lesquels le métal, dans le groupe 4, est à l'état d'oxydation +4 ; d'autres dichlorures de métallocènes existent, tels que le dichlorure de vanadocène (η5-C5H5)2VCl2[20], le dichlorure de niobocène (η5-C5H5)2NbCl2[20] et le dichlorure de molybdocène (η5-C5H5)2MoCl2[22].
- Dichlorures de métallocènes du groupe 4.
Dans l'usage courant, on étend également la désignation de métallocène à des complexes de bis(cyclooctatétraénure) (η8-C8H8)2MIV, où le métal M est à l'état d'oxydation +4, typiquement des actinocènes tels que l'uranocène (η8-C8H8)2U[23], le neptunocène (η8-C8H8)2Np[24], et le plutonocène (η8-C8H8)2Pu[24].
Applications
Comme catalyseurs de polymérisation des alcènes
L'application de loin la plus importante des métallocènes et de leurs dérivés est leur utilisation comme catalyseurs de polymérisation des alcènes pour la production de polyoléfines[25].
Les catalyseurs Ziegler-Natta sont utilisés pour polymériser des alcènes tels que l'éthylène CH2=CH2 ou le propylène CH2=CHCH3 à basse pression et température depuis les années 1950. Dans un mécanisme d'addition-insertion en plusieurs étapes, l'alcène est d'abord lié à un complexe organotitane puis incorporée dans la liaison titane–carbone. L'alcène suivant est ensuite lié au site de coordination qui est libéré dans le processus, et la réaction en chaîne se poursuit par l'incorporation de l'alcène dans la liaison titane–carbone. Les catalyseurs Ziegler-Natta classiques sont des catalyseurs mixtes constitués d'un composé organométallique du groupe 1, du groupe 2 ou groupe 13 (par exemple le triéthylaluminium) dans le groupe principal et d'un composé de métal de transition, principalement du groupe 4, du groupe 5 ou du groupe 6 (par exemple le tétrachlorure de titane) parmi les métaux de transition. Cependant, ils présentent l'inconvénient décisif d'être généralement utilisés comme catalyseurs hétérogènes sur un matériau support, car ils ne sont pas solubles dans les solvants organiques. Par conséquent, en plus des propriétés réelles du catalyseur, les propriétés du matériau de support, la vitesse de diffusion de l'alcène et d'autres réactions d'adsorption jouent également un rôle.
En 1980, Hansjörg Sinn et Walter Kaminsky ont décrit les réactions de polymérisation catalytique de mélanges de dihalogénures de métallocènes (type 1 ci-dessous) avec du méthylaluminoxane (MAO). Ces catalyseurs de Kaminsky permettent la polymérisation de mélanges d'éthylène, de propylène ou d'alcènes avec un rendement et une sélectivité très élevées[26]. Alors que les métallocènes ne montrent qu'une faible activité avec un cocatalyseur alkylaluminium conventionnel, la présence d'un excès de méthylaluminoxane augmente leur réactivité d'un facteur 10 000 ou plus, ce qui les rend cent fois plus actifs qu'un catalyseur Ziegler-Natta traditionnel. Les catalyseurs de Kaminsky sont également solubles dans les hydrocarbures et, contrairement aux catalyseurs Ziegler-Natta, peuvent donc être utilisés directement en solution[27]. Avec les catalyseurs Kaminsky à base de zirconocène, jusqu'à 100 tonnes d'éthylène par gramme de zirconium peuvent être polymérisées avec un temps d'insertion de l'ordre de 10−5 s[27].
-
L'utilisation de métallocènes (1) pour la polymérisation du propylène donne du polypropylène atactique, tandis que les systèmes catalytiques à base de métallocènes à indényles pontés de symétrie C2 (2) ou à fluorényl-cyclopentadiényle pontés de symétrie Cs (3) produisent des polymères respectivement isotactiques et syndiotactiques.
Cinq ans plus tard, Walter Kaminsky et Hans-Herbert Brintzinger ont rapporté qu'en utilisant des ansa-métallocènes de type 2 (ansa-métallocènes à symétrie C2), il est possible d'obtenir du polypropylène ayant un arrangement strictement isotactique. En augmentant la taille des résidus organiques sur les cycles Cp (comme dans le type 3) et/ou en faisant varier les atomes de pontage, l'activité et la sélectivité peuvent être spécifiquement modulées et la distribution de la masse moléculaire des polymères résultants peut être optimisée dans des limites étroites[25],[27].
Le magnésocène ainsi que le bis(cyclopentadiényl)calcium et le bis(cyclopentadiényl)strontium peuvent également être utilisés comme catalyseurs de polymérisation, par exemple pour le méthacrylate de méthyle (MMA)[28].
Notes et références
- (en) « metallocenes », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (de) entrée « Cyclopentadienyl » sur la Römpp Lexikon Chemie en ligne.
- (en) « The Nobel Prize in Chemistry 1973 », sur https://www.nobelprize.org/, (consulté le ).
- (en) George B. Kauffman, « The discovery of ferrocene, the first sandwich compound », Journal of Chemical Education, vol. 60, no 3, , p. 185 (DOI 10.1021/ed060p185, Bibcode 1983JChEd..60..185K, lire en ligne)
- (de) W. Pfab et E. O. Fischer, « Zur Kristallstruktur der Di-cyclopentadienyl-verbindungen des zweiwertigen Eisens, Kobalts und Nickels », Zeitschrift für anorganische und allgemeine Chemie, vol. 274, no 6, , p. 316-322 (DOI 10.1002/zaac.19532740603, lire en ligne)
- (de) E. O. Fischer et R. Jira, « Notizen: Di-cyclopentadienyl-kobalt (II) », Zeitschrift für Naturforschung B, vol. 8, no 6, , p. 327-328 (DOI 10.1515/znb-1953-0615, lire en ligne)
- (de) E. O. Fischer et W. Hafner, « Notizen: Di-cyclopentadienyl-chrom », Zeitschrift für Naturforschung B, vol. 8, no 8, , p. 444-445 (DOI 10.1515/znb-1953-0809, lire en ligne)
- (en) J. M. Birmingham, A. K. Fischer et G. Wilkinson, « The reduction of bis-cyclopentadienyl compounds », Naturwissenschaften, vol. 42, no 4, , p. 96 (DOI 10.1007/BF00617242, lire en ligne)
- (de) Ernst Otto Fischer et Henning Wawersik, « Über aromatenkomplexe von metallen : LXXXVIII. Über monomeres und dimeres dicyclopentadienyl-rhodium und dicyclopentadienyliridium und über ein neues verfahren zur darstellung ungeladener metall-aromaten-komplexe », Journal of Organometallic Chemistry, vol. 5, no 6, , p. 559-567 (DOI 10.1016/S0022-328X(00)85160-8, lire en ligne)
- (en) Geoffrey Wilkinson, « The Preparation and Some Properties of Ruthenocene and Ruthenicinium Salts », Journal of the American Chemical Society, vol. 74, no 23, , p. 6146-6147 (DOI 10.1021/ja01143a538, lire en ligne)
- (de) Ernst Otto Fischer et Heinrich Grubert, « Über Aromatenkomplexe von Metallen, XXIX. Di-cyclopentadienyl-osmium », Chemische Berichte, vol. 92, no 9, , p. 2302-2309 (DOI 10.1002/cber.19590920948, lire en ligne)
- (en) M. L. H. Green, L. Pratt et G. Wilkinson, « 795. Biscyclopentadienylrhenium hydride », Journal of the Chemical Society (Resumed), , p. 3916-3922 (DOI 10.1039/jr9580003916, lire en ligne)
- (en) G. Wilkinson et F. A. Cotton, Chemistry & Industry, no 11, p. 307, Londres, 1954.
- (de) E. O. Fischer et H. Grubert, « Über Aromatenkomplexe von Metallen. IV. Di-cyclopentadienyl-blei », Zeitschrift für anorganische und allgemeine Chemie, vol. 286, nos 5-6, , p. 237-242 (DOI 10.1002/zaac.19562860507, lire en ligne)
- (en) C.-H. Wong, T.-Y. Lee, K.-J. Chao et S. Lee, « Crystal structure of bis(cyclopentadienyl)beryllium at -120°C », Acta Crystallographica Section B, vol. B28, , p. 1662-1665 (DOI 10.1107/S0567740872004820, lire en ligne)
- (en) Arne Almenningen, Arne Haaland et Janusz Lusztyk, « The molecular structure of beryllocene, (C5H5)2Be. A reinvestigation by gas phase electron diffraction », Journal of Organometallic Chemistry, vol. 170,, no 3, , p. 271-284 (DOI 10.1016/S0022-328X(00)92065-5, lire en ligne)
- (en) P. J. Smith, « Organometallic compounds of bivalent tin », Chemistry of Tin, Springer Science & Business Media, 2012, p. 176-197. (ISBN 978-9401149389)
- (en) Richard A. Layfield, « Manganese(ii): the black sheep of the organometallic family », Chemical Society Reviews, vol. 37, no 6, , p. 1098-1107 (PMID 18497923, DOI 10.1039/b708850g, lire en ligne)
- (en) Ei-ichi Negishi et Shouquan Huo, « Synthesis and Reactivity of Zirconocene Derivatives », Titanium and Zirconium in Organic Synthesis, (DOI 10.1002/3527600671.ch1, lire en ligne)
- (en) G. Wilkinson et J. M. Birmingham, « Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta », Journal of the American Chemical Society, vol. 76, no 17, , p. 4281-4284 (DOI 10.1021/ja01646a008, lire en ligne)
- (en) Takeo Taguchi, Yuji Hanzawa, Keisuke Suzuki et Yasuhito Koyama, « Dichlorobis(cyclopentadienyl)hafnium », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rd089s.pub2, lire en ligne)
- (en) R. L. Cooper et M. L. H. Green, « Some bis-π-cyclopentadienyl halides of molybdenum, tungsten, and rhenium », Journal of the Chemical Society A: Inorganic, Physical, Theoretical, , p. 1155-1160 (DOI 10.1039/J19670001155, lire en ligne)
- (en) Andrew Streitwieser Jr. et Ulrich Mueller-Westerhoff, « Bis(cyclooctatetraenyl)uranium (uranocene). A new class of sandwich complexes that utilize atomic f orbitals », Journal of the American Chemical Society, vol. 90, no 26, , p. 7364 (DOI 10.1021/ja01028a044, lire en ligne)
- (en) David G. Karraker, John Austin Stone, Erwin Rudolph Jones Jr. et Norman Edelstein, « Bis(cyclooctatetraenyl)neptunium(IV) and bis(cyclooctatetraenyl)plutonium(IV) », Journal of the American Chemical Society, vol. 92, no 16, , p. 4841-4845 (DOI 10.1021/ja00719a014, lire en ligne)
- (de) Michael Aulbach et Frank Küber, « Metallocene – maßgeschneiderte Werkzeuge zur Herstellung von Polyolefinen », Chemie in unserer Zeit, vol. 28, no 4, , p. 197-208 (DOI 10.1002/ciuz.19940280410, lire en ligne)
- (en) Hansjörg Sinn, Walter Kaminsky, Hans-Jürgen Vollmer et Rüdiger Woldt, « “Living Polymers” on Polymerization with Extremely Productive Ziegler Catalysts », Angewandte Chemie International Edition, vol. 19, no 5, , p. 390-392 (DOI 10.1002/anie.198003901, lire en ligne)
- (en) Walter Kaminsky, « Metallocenes », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.b16_b36.pub2, lire en ligne)
- (en) Aibing Xia, John E. Knox, Mary Jane Heeg, H. Bernhard Schlegel et Charles H. Winter, « Synthesis, Structure, and Properties of Magnesocene Amine Adducts. Structural Distortions Arising from N−H···C5H5- Hydrogen Bonding and Molecular Orbital Calculations Thereof », Organometallics, vol. 22, no 20, , p. 4060-4069 (DOI 10.1021/om030452v, lire en ligne)