« Polymérisation anionique » : différence entre les versions
Pld (discuter | contributions) m polarité (chimie) |
Pld (discuter | contributions) m polarité (chimie) |
||
| Ligne 33 : | Ligne 33 : | ||
<math>\textstyle (M_n^-, Li^+)_3 {\leftrightharpoons} 3 M_n^-, Li^+</math> |
<math>\textstyle (M_n^-, Li^+)_3 {\leftrightharpoons} 3 M_n^-, Li^+</math> |
||
On définit la constante d'agrégation <math> \textstyle K_{ag} = \frac{[(M_n^-, Li^+)_3]}{[M_n^-, Li^+]^3} </math></br> |
On définit la constante d'agrégation <math> \textstyle K_{ag} = \frac{[(M_n^-, Li^+)_3]}{[M_n^-, Li^+]^3} </math></br> |
||
Par définition la vitesse de propagation s'écrit comme ceci: |
Par définition la vitesse de propagation s'écrit comme ceci : |
||
<math>\textstyle v_p = - \frac {\mathrm{d}[M]}{\mathrm{d}[t]} = k_p [M_n^-, Li^+][M] = k_p (\frac{[(M_n^-, Li^+)_3]}{K_{ag}})^{1/3}[M] </math></br> |
<math>\textstyle v_p = - \frac {\mathrm{d}[M]}{\mathrm{d}[t]} = k_p [M_n^-, Li^+][M] = k_p (\frac{[(M_n^-, Li^+)_3]}{K_{ag}})^{1/3}[M] </math></br> |
||
Le rapport <math>\textstyle \frac {k_p}{K_{ag}^{1/3}} </math> donne une constante apparente qui est mesurée expérimentalement. |
Le rapport <math>\textstyle \frac {k_p}{K_{ag}^{1/3}} </math> donne une constante apparente qui est mesurée expérimentalement. |
||
| Ligne 41 : | Ligne 41 : | ||
==Importance du solvant== |
==Importance du solvant== |
||
Il intervient à trois niveaux. |
Il intervient à trois niveaux. |
||
*vitesse de réaction: En milieu [[polaire]], un solvant assez [[dissociant]] sépare les charges d'une paire d'ions et on obtient pratiquement des ions libres. La charge négative ressentie par le monomère augmente et la réaction est accélérée. |
*vitesse de réaction : En milieu [[polarité (chimie)|polaire]], un solvant assez [[dissociant]] sépare les charges d'une paire d'ions et on obtient pratiquement des ions libres. La charge négative ressentie par le monomère augmente et la réaction est accélérée. |
||
*équilibre d'agrégation: Un moyen de limiter l'agrégation est d'ajouter un peu de solvant polaire au milieu et ainsi d'accélérer la réaction. |
*équilibre d'agrégation : Un moyen de limiter l'agrégation est d'ajouter un peu de solvant polaire au milieu et ainsi d'accélérer la réaction. |
||
*[[tacticité]]: Si la réaction est propagée par des ions libres (solvant polaire), on a une [[hybridation]] sp2 et on obtient un polymère [[atactique]] (potentiellement [[amorphe]]). En solvant apolaire, l'hybridation est sp3 et il devient possible d'obtenir un polymère [[isotactique]] ou [[syndiotactique]] (potentiellement [[Taux de cristallinité|cristallisable]]). |
*[[tacticité]] : Si la réaction est propagée par des ions libres (solvant polaire), on a une [[hybridation]] sp2 et on obtient un polymère [[atactique]] (potentiellement [[amorphe]]). En solvant apolaire, l'hybridation est sp3 et il devient possible d'obtenir un polymère [[isotactique]] ou [[syndiotactique]] (potentiellement [[Taux de cristallinité|cristallisable]]). |
||
La température a bien sur un impact. |
La température a bien sur un impact. |
||
Version du 19 décembre 2010 à 22:48
La polymérisation anionique est un type de polymérisation en chaîne dans lequel le centre actif est de nature anionique. Elle est constituée de l'amorçage, la propagation, éventuellement de transfert et de terminaison. Les monomères concernés sont ceux qui possèdent des groupements électro-attracteurs. Ce mode de polymérisation est utilisé avec les alcènes substitués comme le méthylpropène. La réaction de propagation est la suivante (pour le méthylpropène ):
R+ + CH2=C(CH3)2 -> R-CH2-C+(CH3)2
Toute la difficulté de ce mode de polymérisation réside dans l'amorçage. En effet, l'amorçage par simple protonation du monomère peut ne donner que des oligomères.

Amorçage
L'amorçage peut se faire avec une base forte, comme les hydroxydes, les alcoolates, les amidures..
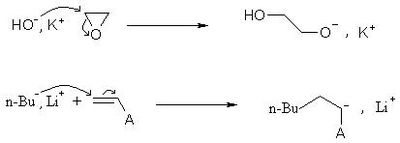
Cette étape permet d'obtenir le centre actif : la charge négative sur le monomère. Il peut s'agir d'ions libres, d'une paire d'ion ou d'une liaison polarisée. La réactivité en dépendra.
L'amorçage peut également se faire par transfert d'électron.
Propagation
La propagation de la charge négative conduit à l'assemblage de motifs en un chaîne, selon par exemple ce mécanisme pour le polystyrène :
Transfert et terminaison
Ces étapes ne sont pas obligatoires, elles n'ont pas lieu en polymérisation vivante par exemple. La répulsion ionique empêche la terminaison par recombinaison des chaînes comme en polymérisation radicalaire, mais d'autres schémas sont possibles:

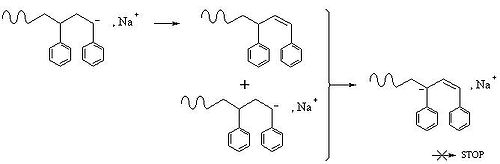
Il faut en général éviter ce qui est protique en polymérisation anionique.
Agrégation et cinétique de réaction
En polymérisation anionique, les amorceurs comme les centres actifs s'agrègent souvent pour former des dimères, trimères ou n-mères en milieu apolaire. L'agrégation est associé à une constante d'équilibre entre un agrégat inactif et des ions actifs. Elle joue un rôle important dans la cinétique de la réaction.
Par exemple si il s'agit de trimère :
On définit la constante d'agrégation
Par définition la vitesse de propagation s'écrit comme ceci :
Le rapport donne une constante apparente qui est mesurée expérimentalement.
L'agrégation ralenti la réaction, mais il est possible de jouer sur le solvant pour limiter cet effet.
Importance du solvant
Il intervient à trois niveaux.
- vitesse de réaction : En milieu polaire, un solvant assez dissociant sépare les charges d'une paire d'ions et on obtient pratiquement des ions libres. La charge négative ressentie par le monomère augmente et la réaction est accélérée.
- équilibre d'agrégation : Un moyen de limiter l'agrégation est d'ajouter un peu de solvant polaire au milieu et ainsi d'accélérer la réaction.
- tacticité : Si la réaction est propagée par des ions libres (solvant polaire), on a une hybridation sp2 et on obtient un polymère atactique (potentiellement amorphe). En solvant apolaire, l'hybridation est sp3 et il devient possible d'obtenir un polymère isotactique ou syndiotactique (potentiellement cristallisable).
La température a bien sur un impact.
Obtention de copolymères à blocs
La copolymérisation vivante anionique est un moyen d'obtenir des copolymères. On assemble un premier bloc sans terminaison, par exemple du polystyrène, puis on fait réagir à la suite de l'isoprène et on aura ainsi un copolymère à bloc Polystyrène-Polyisoprène. Il faut néanmoins assembler les blocs dans un ordre strict, donné par l'échelle de réactivité:
| styrène, diène | PS-, PI-, PBu- |
| métacrylate d'alkyle | PMMA- |
| acrylate d'alkyle | Polyacrylates- |
| lactones, cyclosiloxanes | RCOO-, RSiO- |
| oxiranes | CH2-C(R)O- |
Par exemple il faudra faire réagir le PS- sur un oxirane et non l'inverse (règle du gamma). Par contre les diènes, situés sur une même ligne, peuvent être assemblé dans n'importe quel ordre.
Références
Voir aussi
Modèle:Palette matériaux polymères


![{\displaystyle \textstyle K_{ag}={\frac {[(M_{n}^{-},Li^{+})_{3}]}{[M_{n}^{-},Li^{+}]^{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a13d701056585f29be809abb1a54233a51bc225)
![{\displaystyle \textstyle v_{p}=-{\frac {\mathrm {d} [M]}{\mathrm {d} [t]}}=k_{p}[M_{n}^{-},Li^{+}][M]=k_{p}({\frac {[(M_{n}^{-},Li^{+})_{3}]}{K_{ag}}})^{1/3}[M]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ca98b2f2c10b9117b5e8d54eebfca44ea45a1d8)
