« Ionomère » : différence entre les versions
mAucun résumé des modifications |
m image modifiée |
||
| Ligne 1 : | Ligne 1 : | ||
[[Fichier: |
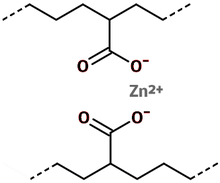
[[Fichier:Ionomer.png|thumb|Exemple de structure intermoléculaire : schéma du pontage ionique -carboxylate-cation bivalent-carboxylate-]] |
||
Un '''ionomère''' est un [[copolymère]] [[thermoplastique]] « [[Réticulation|réticulé]] [[ion]]iquement ». La réticulation améliore la cohésion du [[polymère]] et la [[conductivité électrique]].<br /> |
Un '''ionomère''' est un [[copolymère]] [[thermoplastique]] « [[Réticulation|réticulé]] [[ion]]iquement ». La réticulation améliore la cohésion du [[polymère]] et la [[conductivité électrique]].<br /> |
||
Dans un ionomère, une faible proportion (de 1 à ~10 %) de [[Motif de répétition|motifs de répétition]] porte des [[Groupe fonctionnel|groupes]] ioniques et/ou ionisables. Le pontage ionique entre chaînes est formé par des [[cation]]s ''bi[[Valence (chimie)|valents]]'' tels [[Zinc|Zn]]<sup>++</sup>, [[Calcium|Ca]]<sup>++</sup> et [[Magnésium|Mg]]<sup>++</sup>.<br /> |
Dans un ionomère, une faible proportion (de 1 à ~10 %) de [[Motif de répétition|motifs de répétition]] porte des [[Groupe fonctionnel|groupes]] ioniques et/ou ionisables. Le pontage ionique entre chaînes est formé par des [[cation]]s ''bi[[Valence (chimie)|valents]]'' tels [[Zinc|Zn]]<sup>++</sup>, [[Calcium|Ca]]<sup>++</sup> et [[Magnésium|Mg]]<sup>++</sup>.<br /> |
||
Version du 25 mars 2010 à 00:58
Un ionomère est un copolymère thermoplastique « réticulé ioniquement ». La réticulation améliore la cohésion du polymère et la conductivité électrique.
Dans un ionomère, une faible proportion (de 1 à ~10 %) de motifs de répétition porte des groupes ioniques et/ou ionisables. Le pontage ionique entre chaînes est formé par des cations bivalents tels Zn++, Ca++ et Mg++.
Certaines protéines peuvent être classées dans les ionomères.
Le premier ionomère, apparu en 1964, est commercialisé sous le nom de Surlyn (Du Pont). Il s'agit d'un copolymère de l'éthylène avec un monomère de vinyle (acide méthacrylique) polaire.
Par exemple, le groupe ionisable situé le long des chaînes après copolymérisation peut être un carboxyle. Après traitement par un sel de zinc, un groupe carboxylate de zinc peut donner une liaison ionique :
- ~-COO-(Zn++)-OOC-~.
Bien que le groupe carboxyle réduise la cristallinité, les liaisons ioniques augmentent la rigidité. Ces liaisons sont de moyenne énergie (10-20 kcal/mol, contre 60-100 kcal/mol pour des liaisons covalentes) et réversibles à chaud.
Les ionomères sont flexibles, transparents et sans danger pour la santé, conservent leur forme à chaud, résistent à la perforation, à l'abrasion, aux chocs jusqu'à 100 °C (utilisation comme enveloppe de balle de golf), aux bases, aux solvants organiques, aux graisses et huiles, et aux intempéries comme les polyoléfines. Cependant, leur tenue aux acides, aux alcools, à l'acétone, aux hydrocarbures aromatiques et chlorés est faible.
Ils sont surtout transformés en feuilles pour le formage sous vide (très haut rapport d'étirage, utilisation comme membrane hémiperméable et film barrière pour pellicules multicouches obtenues par coextrusion).
Selon les types, la densité se situe entre 0,93 et 0,97, et la température maximale d'utilisation entre 70 et 80 °C. La température de transition vitreuse Tg avoisine 10 °C. Des types difficilement inflammables (ILO plus élevé) sont disponibles.
