« Saponification » : différence entre les versions
Ajout d'un titre "Techniques de saponification" et des sous-tires "Saponification à chaud" et "Saponification à froid" |
Modification du sous titre "saponification à froid". Ajout d'un lien vers la page "savon à froid" |
||
| Ligne 46 : | Ligne 46 : | ||
=== Saponification à froid === |
=== Saponification à froid === |
||
La saponification à froid consiste à réaliser la réaction de saponification à température ambiante, en intégrant la quantité exacte de soude nécessaire à la transformation des graisses en savon. C'est |
La saponification à froid consiste à réaliser la réaction de saponification à température ambiante (entre 40 et 50 degrés), en intégrant la quantité exacte de soude nécessaire à la transformation des graisses en savon. C'est une réaction totale, qui ne s’arrête que lorsque l’un des composants est épuisé, garantissant de la douceur au [[savon à froid]]. Des corps gras additionnels sont ajoutés en fin de préparation afin de garantir une transformation totale de la soude en savon. |
||
Les savons subissent ensuite une période de «cure» allant de 4 à 6 semaines. |
|||
| ⚫ | |||
Cette méthode est lente et moins polluante que la méthode à chaud. Elle ne permet pas une production industrielle du fait de sa durée de fabrication, mais elle produit un [[savon]] de qualité, qui conserve les propriétés des huiles utilisées à la fin de la réaction chimique totale, et naturellement riche en [[Glycérol|glycérine]]. |
|||
| ⚫ | La tenue du [[savon à froid]] est plus courte, et son prix est plus élevé au vu du temps nécessaire à sa fabrication. <ref>{{Ouvrage|langue=Français|auteur1=Leanne Chevalier|prénom2=Sylvain Chevalier|titre=Je crée mes savons au naturel : l'art de la savonnerie à froid|éditeur=Terre Vivante|date=2010|pages totales=119|isbn=9-782360-980079}}</ref> |
||
== Application : synthèse de savon == |
== Application : synthèse de savon == |
||
Version du 13 avril 2021 à 10:39
La saponification est, dans le cadre général, une réaction chimique transformant un ester en ions carboxylates et un alcool. Il s'agit en fait de l'hydrolyse d'un ester en milieu basique. Cette réaction permet la synthèse du savon.
Histoire
Initialement cette réaction est connue pour transformer le mélange d'un ester de glycérol et d'une base forte en un mélange de savons (ou sels d'acide gras) et glycérol, d'où son nom. Elle a été identifiée en 1823 par le chimiste français Michel-Eugène Chevreul, qui a montré que les triglycérides peuvent être considérés comme des combinaisons chimiques entre le glycérol et des acides gras (autrement dit, un triglycéride est un composé dont la molécule contient un résidu de glycérol et trois résidus d'acides gras).
Réaction
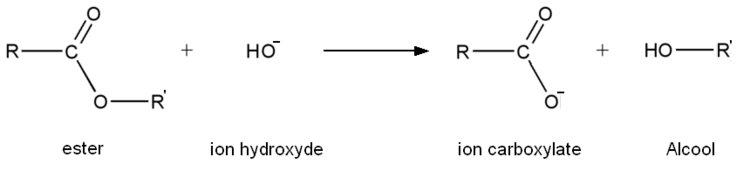
Propriétés
La saponification est une réaction lente, mais totale. C'est une réaction exothermique.
Il existe plusieurs procédés de saponification :
- le procédé discontinu ou marseillais est ancien, mais toujours utilisé ;
- les procédés continus.
Pour accélérer la réaction, on peut agir sur plusieurs facteurs :
- maintenir une température élevée ;
- agiter le mélange soude - ester pour permettre aux réactifs de se rencontrer plus facilement et maintenir une émulsion.
Mécanisme
Le mécanisme de la réaction se décompose en trois étapes (plus une acidification du milieu si on veut ré-obtenir un acide carboxylique, et non plus un ion carboxylate).
- Première étape : addition nucléophile de l'ion HO− sur l'ester.

- Seconde étape : élimination du groupe alcoolate.

À ce stade, la réaction pourrait être terminée et avoir une utilité (pour hydrolyser un ester, il suffirait de rajouter de la soude ou de la potasse). Cette étape forme un acide carboxylique, acide faible (pKa compris en général entre 3 et 4, mais relativement le plus fort dans le milieu, l'autre étant l'eau) et une base très forte, l'ion alcoolate (pKa compris entre 18 et 20). Il y a donc une réaction acide-base entre l'acide le plus fort et la base la plus forte, donc transformation de l'acide carboxylique en ion carboxylate.
- Troisième étape : réaction acide-base entre l'acide carboxylique et l'ion alcoolate.
Comme on peut le remarquer, cette réaction est la seule du mécanisme qui soit irréversible, et (quasiment) totale (1014 < K < 1017). Ainsi elle déplace les équilibres des réactions précédentes (en consommant entièrement leurs produits), les rendant elles aussi totales (ou presque).
Dans le cadre de la synthèse d'un savon, on peut s'arrêter à cette dernière étape. En revanche, si l'on veut obtenir un acide carboxylique, il faut ré-acidifier le milieu :
Techniques de saponification
Saponification à chaud
La saponification à chaud est une technique industrielle de fabrication du savon, où les matières grasses qui le composent sont chauffées en présence d'une grande quantité de soude, afin d’assurer la transformation totale des corps gras en savon. Le mélange est chauffé pendant plusieurs heures voire jours et remué régulièrement. La pâte à savon est ensuite rincée abondamment afin d'éliminer la soude en excès. Puis le savon est coulé et refroidit, et laissé à sécher pendant 24 heures. Il utilisable immédiatement après.
C’est la méthode de fabrication la plus couramment utilisée dans les industries savonnières, rapide, assez consommatrice en énergie et en eau. Elle produit un savon de qualité moyenne, avec un fort pouvoir lavant et une longue tenue, mais agressif pour la peau. Le savon à chaud produit industriellement est souvent composé d’huiles peu onéreuses (huile de palme, huile de coprah), permettant une fabrication massive à prix moindre. Cette technique est notamment utilisée pour produire le savon de Marseille (huile d'olive) et le savon d’Alep (huile de laurier). [1]
Saponification à froid
La saponification à froid consiste à réaliser la réaction de saponification à température ambiante (entre 40 et 50 degrés), en intégrant la quantité exacte de soude nécessaire à la transformation des graisses en savon. C'est une réaction totale, qui ne s’arrête que lorsque l’un des composants est épuisé, garantissant de la douceur au savon à froid. Des corps gras additionnels sont ajoutés en fin de préparation afin de garantir une transformation totale de la soude en savon.
Les savons subissent ensuite une période de «cure» allant de 4 à 6 semaines.
Cette méthode est lente et moins polluante que la méthode à chaud. Elle ne permet pas une production industrielle du fait de sa durée de fabrication, mais elle produit un savon de qualité, qui conserve les propriétés des huiles utilisées à la fin de la réaction chimique totale, et naturellement riche en glycérine.
La tenue du savon à froid est plus courte, et son prix est plus élevé au vu du temps nécessaire à sa fabrication. [2]
Application : synthèse de savon
Au cours de cette réaction, des corps gras (graisses ou huiles) sont hydrolysés en milieu basique par une base, généralement l'hydroxyde de potassium (KOH) ou l'hydroxyde de sodium (NaOH), à une température comprise entre 80 °C et 100 °C. La température élevée sert à accélérer la réaction de saponification, car c'est un facteur cinétique. La saponification des corps gras produit du glycérol et un mélange de carboxylates (de sodium ou de potassium) qui constitue le savon. À noter que les carboxylates de sodium (Na) produisent des savons « durs » et que les carboxylates de potassium (K) produisent des savons « mous ou liquides ».

L’indice de saponification est un des paramètres qui permettent d'apprécier la qualité d'une huile végétale. C'est la quantité de KOH, exprimée en milligrammes, nécessaire à la saponification d'un gramme d'huile.
Chaque corps gras ayant un indice de saponification particulier, il existe des calculateurs de saponification en ligne permettant de calculer les bonnes proportions nécessaires à la fabrication d'un savon en fonction des corps gras utilisés[3]
Références
- « ZOOM sur le savon à froid », sur Atelier Populaire Paris (consulté le )
- Leanne Chevalier, Je crée mes savons au naturel : l'art de la savonnerie à froid, Terre Vivante, , 119 p. (ISBN 9-782360-980079)
- Calculateur de saponification en ligne.

