« 1,6-Diisocyanatohexane » : différence entre les versions
m →Utilisation : oups |
m Ajout de paramètres manquants dans {{Traduction/Référence}} pour 2 traductions |
||
| Ligne 171 : | Ligne 171 : | ||
== Notes et références == |
== Notes et références == |
||
{{Traduction/Référence|lang1=en|art1=Hexamethylene diisocyanate|id1=|lang2=de|art2=Hexamethylendiisocyanat|id2=}}. |
{{Traduction/Référence|lang1=en|art1=Hexamethylene diisocyanate|id1=883988738|lang2=de|art2=Hexamethylendiisocyanat|id2=190240880}}. |
||
* Page PubChem CID {{CID|13192}}. |
* Page PubChem CID {{CID|13192}}. |
||
<references /> |
<references /> |
||
Version du 26 août 2019 à 23:38
| 1,6-diisocyanatohexane | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,6-diisocyanatohexane | ||
| Synonymes |
diisocyanate d'hexaméthylène |
||
| No CAS | |||
| No ECHA | 100.011.350 | ||
| No CE | 212-485-8 | ||
| No RTECS | MO1740000 | ||
| PubChem | 13192 | ||
| ChEBI | 53578 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore à jaunâtre avec une forte odeur[1] | ||
| Propriétés chimiques | |||
| Formule | C8H12N2O2 [Isomères] |
||
| Masse molaire[2] | 168,193 1 ± 0,008 2 g/mol C 57,13 %, H 7,19 %, N 16,66 %, O 19,03 %, |
||
| Propriétés physiques | |||
| T° fusion | −67 °C[1],[3] | ||
| T° ébullition | 255 °C (décomp.)[1],[3] 121-122 °C à 9 mmHg |
||
| Masse volumique | 1,04 g·cm-3 à 25 °C[3] | ||
| T° d'auto-inflammation | 454 °C[3] | ||
| Point d’éclair | 140 °C[3] | ||
| Limites d’explosivité dans l’air | vol% in air : 0,9-9,5[3] | ||
| Pression de vapeur saturante | 0,7 Pa à 20 °C 2,2 Pa à 30 °C 14 Pa à 50 °C[1] |
||
| Propriétés optiques | |||
| Indice de réfraction | = 1,4585[3] | ||
| Précautions | |||
| SGH[3]P | |||
| H315, H317, H319, H331, H334, H335, P260, P280, P285, P302+P350, P304+P340, P305+P351+P338 et P403+P233 |
|||
| Transport[3] | |||
|
|||
| Écotoxicologie | |||
| LogP | (eau/octanol) 1,08[3] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
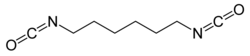
Le 1,6-diisocyanatohexane ou diisocyanate d'hexaméthylène (HDI de l'anglais hexamethylene diisocyanate) est un composé organique de formule semi-développée OCN-(CH2)6-NCO. C'est un diisocyanate aliphatique liquide toxique, incolore à jaunâtre et avec une odeur âcre[1].
Synthèse et propriétés
Par rapport aux autres diisocyanates du commerce, le HDI est produit en quantités relativement petites, représentant seulement 3,4% du marché mondial de diisocyanates en 2000[4]. Il est produit par phosgénation d'hexaméthylènediamine. Les vapeurs de diisocyanate d'hexaméthylène sont six fois plus lourdes que l'air[3]. Ce composé peut réagir violemment ou explosivement avec les alcools en présence de bases s'il n'est pas suffisamment dilué[5] et réagit aussi avec l'eau[3]. La limite de la perception absolue de l'odeur du HDI dans l'air est de 0,01 ppm soit 68,8 μg/m3 et la reconnaissance sûre à 100% de son odeur à 0,02 ppm[3].
Utilisation
Les diisocyanates aliphatiques sont utilisés dans des applications spéciales, telles que les revêtements en émail (peinture-émail en polyuréthane), qui résistent à l'abrasion et à la dégradation par les rayons ultraviolets. Ces propriétés sont particulièrement souhaitables dans, par exemple, la peinture extérieure appliquée aux avions et aux bateaux. Le HDI est également vendu oligomérisé en tant que trimère sous forme d'un biuret. Bien que plus visqueux sous cette forme, cela réduit sa volatilité et sa toxicité. Au moins trois entreprises vendent ce composé sous cette forme dans le commerce.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Hexamethylene diisocyanate » (voir la liste des auteurs) et en allemand « Hexamethylendiisocyanat » (voir la liste des auteurs)..
- Page PubChem CID 13192.
- Entrée « Hexamethylene-1,6-diisocyanate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 août 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID 13192.
- Christian Six, Frank Richter, Isocyanates, Organic, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005. DOI 10.1002/14356007.a14_611.
- P.G. Urben, M.J. Pitt, Bretherick's Handbook of Reactive Chemical Hazards, 8e Edition, Butterworth/Heinemann, 2017, vol. 1, p. 596. (ISBN 978-0-08-100971-0).




