« Changement d'état » : différence entre les versions
Révocation des modifications de 51.36.127.75 (retour à la dernière version de Salebot) ; Vandalisme |
J'ai préciser les changements d'état gaz-plasma dans la partie Nom des changements d'état |
||
| Ligne 17 : | Ligne 17 : | ||
* de gazeux à liquide : [[liquéfaction]] ou [[condensation]] liquide ; le mot "liquide" étant souvent omis par abus de langage ; |
* de gazeux à liquide : [[liquéfaction]] ou [[condensation]] liquide ; le mot "liquide" étant souvent omis par abus de langage ; |
||
* de gazeux à plasma : [[ionisation]] ; |
* de gazeux à plasma : [[ionisation]] ; |
||
* de plasma à gazeux : désionisation. |
* de plasma à gazeux : désionisation. (Bien que le passage entre plasma et gaz tient plus de la réaction chimique que du changement d'état, puisque l'état gaz est conservé) |
||
Mais en thermodynamique, un terme spécifique exclusif est attribué à chacune des transitions<ref>Voir (en ligne), le cours de [http://www.oamp.fr/people/amram/enseignement/thermodynamique/03_cours_thermo.pdf Thermodynamique] {{pdf}}, {{1re|année}} de [[Master (France)|Master]] (2008-2009) p. 85/112 (vignette 43). Il en est de même dans des ouvrages plus anciens tels que les suivants : [1]. C. Chaussin, G. Hilly - ''Chaleur et Themodynamique'' (Tome 1) - Écoles d'Ingénieurs [[Arts et Métiers ParisTech|Arts et Métiers]], Écoles d'Ingénieurs - BET (Bibliothèque de l'Enseignement Technique) - Dunod (1962) {{p.|171}}, 172 ; [2]. M. Joyal - ''Thermodynamique'' - Classes de [[Mathématiques Spéciales]] - Masson (1965) {{p.|96}} ; [3]. Brénon-Audat et al. - ''Thermodynamique chimique'' - [[Premier cycle universitaire|{{1er}} Cycle]] - [[Classe préparatoire aux grandes écoles|Classes préparatoires]] - Hachette (1993) p. 206 ; [4]. ''Dictionnaire de Physique expérimentale'' Quaranta - Tome II - Thermodynamique et applications - Pierron (1997) p. 452 à 456 {{ISBN|2 7085-0168-2}}.</ref>. Ainsi on dira : |
Mais en thermodynamique, un terme spécifique exclusif est attribué à chacune des transitions<ref>Voir (en ligne), le cours de [http://www.oamp.fr/people/amram/enseignement/thermodynamique/03_cours_thermo.pdf Thermodynamique] {{pdf}}, {{1re|année}} de [[Master (France)|Master]] (2008-2009) p. 85/112 (vignette 43). Il en est de même dans des ouvrages plus anciens tels que les suivants : [1]. C. Chaussin, G. Hilly - ''Chaleur et Themodynamique'' (Tome 1) - Écoles d'Ingénieurs [[Arts et Métiers ParisTech|Arts et Métiers]], Écoles d'Ingénieurs - BET (Bibliothèque de l'Enseignement Technique) - Dunod (1962) {{p.|171}}, 172 ; [2]. M. Joyal - ''Thermodynamique'' - Classes de [[Mathématiques Spéciales]] - Masson (1965) {{p.|96}} ; [3]. Brénon-Audat et al. - ''Thermodynamique chimique'' - [[Premier cycle universitaire|{{1er}} Cycle]] - [[Classe préparatoire aux grandes écoles|Classes préparatoires]] - Hachette (1993) p. 206 ; [4]. ''Dictionnaire de Physique expérimentale'' Quaranta - Tome II - Thermodynamique et applications - Pierron (1997) p. 452 à 456 {{ISBN|2 7085-0168-2}}.</ref>. Ainsi on dira : |
||
Version du 6 février 2018 à 13:55

En thermodynamique, un changement d'état est une transition de phase lors du passage d'un état de la matière à un autre. Les trois principaux états de la matière sont : solide, liquide et gazeux, mais il existe plusieurs autres états moins courants : plasma, fluide supercritique, mésophase...
Le changement d'état d'un corps pur est provoqué par une modification de sa pression, de sa température et/ou de son volume. Il est possible de représenter les états et les changements d'état sur un diagramme de phase tridimensionnel (P, V, T) ; en effectuant des projections de ce diagramme sur différents plans, on obtient les diagrammes bidimensionnels (P, T) et (P, V).
Le point triple est un point du diagramme de phase qui correspond à la coexistence de trois états solide, liquide et gazeux d'un corps pur. Il est unique et défini par une température et une pression données.
Noms des changements d'état
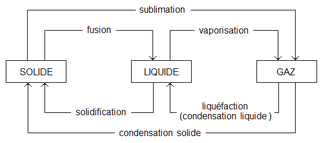
Dans le langage courant un même changement d'état peut être désigné par plusieurs termes :
- de solide à liquide : fusion ;
- de solide à gazeux : sublimation ;
- de liquide à solide : solidification ;
- de liquide à gazeux : vaporisation, qui peut prendre la forme d'une ébullition ou d'une évaporation ;
- de gazeux à solide : condensation solide, déposition ou sublimation inverse ;
- de gazeux à liquide : liquéfaction ou condensation liquide ; le mot "liquide" étant souvent omis par abus de langage ;
- de gazeux à plasma : ionisation ;
- de plasma à gazeux : désionisation. (Bien que le passage entre plasma et gaz tient plus de la réaction chimique que du changement d'état, puisque l'état gaz est conservé)
Mais en thermodynamique, un terme spécifique exclusif est attribué à chacune des transitions[1]. Ainsi on dira :
- de gazeux à solide : condensation ;
- de gazeux à liquide : liquéfaction.
Changements d'état de l'eau

À pression atmosphérique normale (1013,25 hPa), l'eau pure, distillée, est solide (glace) pour une température inférieure à 0 °C, liquide pour une température comprise entre 0 °C et 100 °C, et à l'état gazeux (vapeur d'eau) pour des températures supérieures.
À pression plus faible, le changement d'état se produit pour des températures plus basses. Ainsi, l'eau bout à une température inférieure à 100 °C en montagne car la pression diminue avec l'altitude.
Notes et références
- Voir (en ligne), le cours de Thermodynamique [PDF], 1re année de Master (2008-2009) p. 85/112 (vignette 43). Il en est de même dans des ouvrages plus anciens tels que les suivants : [1]. C. Chaussin, G. Hilly - Chaleur et Themodynamique (Tome 1) - Écoles d'Ingénieurs Arts et Métiers, Écoles d'Ingénieurs - BET (Bibliothèque de l'Enseignement Technique) - Dunod (1962) p. 171, 172 ; [2]. M. Joyal - Thermodynamique - Classes de Mathématiques Spéciales - Masson (1965) p. 96 ; [3]. Brénon-Audat et al. - Thermodynamique chimique - 1er Cycle - Classes préparatoires - Hachette (1993) p. 206 ; [4]. Dictionnaire de Physique expérimentale Quaranta - Tome II - Thermodynamique et applications - Pierron (1997) p. 452 à 456 (ISBN 2 7085-0168-2).

