« Saponification » : différence entre les versions
Aucun résumé des modifications |
Aucun résumé des modifications Balises : Texte en majuscules Éditeur visuel |
||
| Ligne 1 : | Ligne 1 : | ||
EN GROS SA CREIN PAS LE SAVON |
|||
== Histoire == |
== Histoire == |
||
Version du 8 novembre 2016 à 17:03
EN GROS SA CREIN PAS LE SAVON
Histoire
Initialement cette réaction est connue pour transformer le mélange d'un ester de glycérol et d'une base forte en un mélange de savon (ou acide gras) et glycérol, d'où son nom. Elle a été expliquée en 1823 par le chimiste français Michel-Eugène Chevreul qui a démontré que les corps gras sont formés d’une combinaison entre le glycérol et des acides gras.
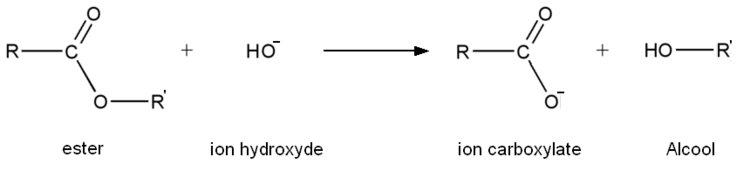
Réaction
Propriétés
La saponification est une réaction lente mais totale. C'est une réaction exothermique.
Il existe plusieurs procédés de saponification :
- le procédé discontinu ou marseillais est ancien mais toujours utilisé ;
- les procédés continus.
Pour accélérer la réaction, on peut agir sur plusieurs facteurs :
- maintenir une température élevée ;
- agiter le mélange soude - ester pour permettre aux réactifs de se rencontrer plus facilement et maintenir une émulsion.
Mécanisme
Il se décompose en trois étapes (plus une acidification du milieu si on veut ré-obtenir un acide carboxylique, et non plus un ion carboxylate).
- Première étape : addition de HO− sur l'ester.

- Seconde étape : élimination du groupe alcoolate.

À ce stade, la réaction pourrait être terminée et avoir une utilité (pour hydrolyser un ester, il suffirait de rajouter de la soude ou de la potasse). Cette étape forme un acide carboxylique, acide faible (pKa compris en général entre 3 et 4, mais relativement le plus fort dans le milieu, l'autre étant l'eau) et une base très forte, l'ion alcoolate (pKa compris entre 18 et 20). Il y a donc une réaction acide-base entre l'acide le plus fort et la base la plus forte, donc transformation de l'acide carboxylique en ion carboxylate.
- Troisième étape : réaction acide-base entre l'acide carboxylique et l'ion alcoolate.
Comme on peut le remarquer, cette réaction est la seule du mécanisme qui soit irréversible, et (quasiment) totale (1014 < K < 1017). Ainsi elle déplace les équilibres des réactions précédentes (en consommant entièrement leurs produits), les rendant elles aussi totales (ou presque).
Dans le cadre de la synthèse d'un savon, on peut s'arrêter à cette dernière étape. Par contre, si l'on veut obtenir un acide carboxylique, il faut réacidifier le milieu :
Application : synthèse de savon
Au cours de cette réaction, des corps gras (graisses ou huiles) sont hydrolysés en milieu basique par une base, généralement l'hydroxyde de potassium (KOH) ou l'hydroxyde de sodium (NaOH), à une température comprise entre 80 °C et 100 °C. La température élevée sert à accélérer la réaction de saponification, car c'est un facteur cinétique. La saponification des corps gras produit du glycérol et un mélange de carboxylates (de sodium ou de potassium) qui constitue le savon. À noter que les carboxylates de sodium (Na) produisent des savons « durs » et que les carboxylates de potassium (K) produisent des savons « mous ou liquides ».

L'indice de saponification est un des paramètres qui permettent d'apprécier la qualité d'une huile végétale. C'est la quantité de KOH, exprimée en milligrammes, nécessaire à la saponification d'un gramme d'huile.
Chaque corps gras ayant un indice de saponification particulier, il existe des calculateurs de saponification en ligne permettant de calculer les bonnes proportions nécessaires à la fabrication d'un savon en fonction des corps gras utilisés[1]

