« Catalyse de Ziegler-Natta » : différence entre les versions
m Robot : Correction modèle {{Lien web}} : retrait des http dans le paramètre site (requête) et indication des éventuels liens brisés. |
|||
| (15 versions intermédiaires par 7 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
La '''catalyse de Ziegler-Natta''', ou '''procédé Ziegler-Natta''', est un [[procédé industriel]] de production de [[polyoléfine]]s à [[tacticité]] contrôlée. Mis au point par [[Karl Ziegler]] et [[Giulio Natta]] au début des [[années 1950]], ce procédé leur valut le [[prix Nobel de chimie]] en 1963<ref name="NobelPrize.org"> |
|||
{{ébauche|chimie}} |
|||
{{Lien web |
|||
La '''catalyse de Ziegler-Natta''', ou '''procédé Ziegler-Natta''', est un procédé chimique permettant la synthèse de [[polymère vinylique|polymères vinyliques]] à la [[tacticité]] contrôlée. Mise au point par [[Karl Ziegler]] et [[Giulio Natta]] au début des années 1950, elle leur vaut le [[prix Nobel]] de chimie dès 1963. Initialement basée sur un catalyseur obtenu à partir de [[tétrachlorure de titane]] et de [[triéthylaluminium]], le procédé a connu plusieurs modifications et les dernières générations de catalyseurs font intervenir des [[complexe de coordination|complexes]] de [[zirconium]]. |
|||
| langue = en |
|||
| url = https://www.nobelprize.org/prizes/chemistry/1963/summary/ |
|||
| titre = The Nobel Prize in Chemistry 1963 |
|||
| site = nobelprize.org |
|||
| consulté le = 26 décembre 2022 |
|||
}}.</ref>. Il repose historiquement sur la [[polymérisation coordinative]] à l'aide de [[catalyse]]urs mixtes formés d'un [[composé organométallique]] des [[Groupe du tableau périodique|groupes]] {{I}}, {{II}} ou {{III}} du [[groupe principal]], c'est-à-dire des groupes [[Groupe 1 du tableau périodique|1]], [[Groupe 2 du tableau périodique|2]] et [[Groupe 13 du tableau périodique|13]] du [[Tableau périodique des éléments|tableau périodique]] (par exemple le [[triéthylaluminium]] {{fchim|Al|2|(C|2|H|5|)|6}}) activant un composé de [[métal de transition]], principalement des groupes [[Groupe 4 du tableau périodique|4]], [[Groupe 5 du tableau périodique|5]] et [[Groupe 6 du tableau périodique|6]] (par exemple le [[tétrachlorure de titane]] {{fchim|TiCl|4}})<ref name="10.1002/0471238961.2609050703050303.a01.pub2"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Adriano G. Fisch |
|||
| titre = Ziegler-Natta Catalysts |
|||
| périodique = Kirk-Othmer Encyclopedia of Chemical Technology |
|||
| volume = |
|||
| numéro = |
|||
| jour = 16 |
|||
| mois = décembre |
|||
| année = 2019 |
|||
| pages = |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/0471238961.2609050703050303.a01.pub2 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1002/0471238961.2609050703050303.a01.pub2 |
|||
| pmid = |
|||
| bibcode = |
|||
}}.</ref>. Ce procédé de [[catalyse hétérogène]] a par la suite connu plusieurs optimisations, les générations plus récentes de catalyseurs Ziegler-Natta faisant par exemple intervenir des [[Complexe de coordination|complexes]] de [[zirconium]] ou d'[[hafnium]] à [[Ligand (chimie)|ligands]] [[ansa-Métallocène|{{nobr|''ansa''-métallocènes}}]] de [[cyclopentadiényle]], [[Fluorène|fluorényle]], [[Indène|indényle]]{{etc.}} activés par un [[méthylaluminoxane]] ([[Catalyseur de Kaminsky|catalyseurs de Kaminsky]]) mais peuvent aussi faire appel à des ligands [[Denticité|multidentés]] à base d'[[oxygène]] et d'[[azote]]<ref name="10.1002/9780470504437">{{en}} Ray Hoff et Robert T. Mathers, ''Handbook of Transition Metal Polymerization Catalysts'', John Wiley & Sons, 2010 ({{DOI|10.1002/9780470504437}}). {{ISBN|978-0470137987}}</ref> dans le cadre d'une [[catalyse homogène]]. Le procédé Ziegler-Natta trouve une application technique dans la synthèse industrielle du [[polyéthylène]] et du [[polypropylène]], particulièrement dans la polymérisation d'[[alcène]]s terminaux ([[éthylène]] et alcènes à groupe [[vinyle]]) : |
|||
:{{mvar|n}} {{fchim|CH|2|{{=}}CHR}} ⟶ –{{fchim|[CH|2|–CHR]|{{mvar|n }}}}–. |
|||
== |
== Histoire == |
||
En 1953, [[Karl Ziegler]] découvre cette catalyse en réussissant à polymériser à basse pression de l'[[éthène]] pour former du [[polyéthylène]] haute densité<ref name="H925"/>. L'année suivante, [[Giulio Natta]] applique la même méthode pour obtenir du [[polypropylène]] [[isotactique]]<ref name="H925"/>. |
|||
Le [[polyéthylène]] est produit par [[polymérisation radicalaire]] depuis 1938 à des pressions atteignant {{unité|300|MPa}} et des températures allant jusqu'à {{tmp|300|°C}}. Au début des [[années 1950]], une équipe de la [[Phillips Petroleum Company]] découvrit des [[catalyseur]]s au [[chrome]] permettant la [[polymérisation]] de l'[[éthylène]] à basse température, ce qui aboutit à la mise au point du [[catalyseur Phillips]]. En 1953, [[Karl Ziegler]] découvrit que l'[[éthylène]] pouvait être [[Polymérisation|polymérisé]] en polyéthylène à des pressions et des températures proches des conditions ambiantes normales à l'aide de [[tétrachlorure de titane]] {{fchim|TiCl|4}} activé au [[chlorure de diéthylaluminium]] {{nobr|{{fchim|[(CH|3|CH|2|)|2|Al(''µ''-Cl)]|2}}}}<ref name="10.1002/ange.19550671610"> |
|||
{{Article |
|||
| langue = de |
|||
| nom1 = Karl Ziegler, E. Holzkamp, H. Breil et H. Martin |
|||
| titre = Polymerisation von Äthylen und anderen Olefinen |
|||
| périodique = Angwandte Chemie |
|||
| volume = 67 |
|||
| numéro = 16 |
|||
| jour = 21 |
|||
| mois = août |
|||
| année = 1955 |
|||
| pages = 426-426 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/ange.19550671610 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1002/ange.19550671610 |
|||
| pmid = |
|||
| bibcode = 1955AngCh..67..426Z |
|||
}}.</ref>. Le polyéthylène produit de cette manière, dit ''[[polyéthylène haute densité]]'' ({{Abréviation|PE-HD|PolyEthylene, High-Density}}), avait des propriétés mécaniques différentes de celles du polyéthylène produit jusqu'alors par polymérisation radicalaire à pression et températures élevées, dit ''[[polyéthylène basse densité]]'' ({{Abréviation|PE-LD|PolyEthylene, Low-Density}}), car il était linéaire et non pas ramifié, d'où un [[taux de cristallinité]] plus élevée, ce qui lui conférait une [[Dureté (matériau)|dureté]] et une [[Raideur (mécanique)|raideur]] également plus élevées. Ce procédé fut mis en œuvre industriellement quelques mois après sa découverte<ref name="10.1002/anie.200300580"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Ludwig L. Böhm |
|||
| titre = The Ethylene Polymerization with Ziegler Catalysts: Fifty Years after the Discovery |
|||
| périodique = Angewandte Chemie International Edition |
|||
| volume = 42 |
|||
| numéro = 41 |
|||
| jour = 27 |
|||
| mois = octobre |
|||
| année = 2003 |
|||
| pages = 5010-5030 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/anie.200300580 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1002/anie.200300580 |
|||
| pmid = 14595622 |
|||
| bibcode = |
|||
}}.</ref>. [[Giulio Natta]] utilisa du [[Chlorure de titane(III)|trichlorure de titane]] {{nobr|{{math|α}}-{{fchim|TiCl|3}}}} activé par du [[triéthylaluminium]] {{fchim|Al|2|(CH|2|CH|3|)|6}} pour obtenir le premier [[polypropylène]] [[Tacticité|isotactique]]<ref name="978-1483223865">{{en}} Giulio Natta et Ferdinando Danusso, ''Stereoregular Polymers and Stereospecific Polymerizations: The Contributions of Giulio Natta and His School to Polymer Chemistry'', {{vol.|1}}, Pergamon Press, 1967. {{ISBN|978-1483223865}}</ref>. |
|||
<gallery mode="packed" heights="90px" caption="[[Tacticité]] du [[polypropylène]]."> |
|||
Fichier:Mm triad.png|{{Centrer|Isotactique.}} |
|||
Fichier:Rr triad.PNG|{{Centrer|Syndiotactique.}} |
|||
</gallery> |
|||
Dans les [[années 1970]], le [[chlorure de magnésium]] {{fchim|MgCl|2}} se révéla être un activateur très efficace des catalyseurs à base de titane tels que [[Tétrachlorure de titane|{{fchim|TiCl|4}}]]<ref name="10.1002/pola.10962"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Norio Kashiwa |
|||
| titre = The discovery and progress of {{fchim|MgCl|2|-supported TiCl|4}} catalysts |
|||
| périodique = Journal of Polymer Science A |
|||
| volume = 42 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = janvier |
|||
| année = 2004 |
|||
| pages = 1-8 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/pola.10962 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1002/pola.10962 |
|||
| pmid = |
|||
| bibcode = |
|||
}}.</ref>, au point qu'il n'était plus nécessaire d'éliminer les résidus de catalyseur du produit final. Ceci a permis la commercialisation de [[polyéthylène basse densité linéaire]] ({{Abréviation|PE-LLD|PolyEthylene, Linear Low-Density}}) et le développement de [[copolymère]]s non cristallins<ref name="10.1002/9780470504437.ch6"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Thomas E. Nowlin, Robert I. Mink et Yury V. Kissin |
|||
| titre = Supported Magnesium/Titanium-Based Ziegler Catalysts for Production of Polyethylene |
|||
| périodique = Handbook of Transition Metal Polymerization Catalysts |
|||
| volume = |
|||
| numéro = |
|||
| jour = 8 |
|||
| mois = février |
|||
| année = 2010 |
|||
| pages = 131-155 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/9780470504437.ch6 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1002/9780470504437.ch6 |
|||
| pmid = |
|||
| bibcode = |
|||
}}.</ref>. À titre indicatif, le degré de ramification de ces différents types de polyéthylène peut être schématisé de la façon suivante : |
|||
{| class="wikitable centre" |
|||
|- |
|||
| [[Polyéthylène basse densité|{{Abréviation|PE-LD|PolyEthylene, Low-Density}}]] || [[Fichier:PE-LD schematic.svg|Représentation schématique de PE-LD (polyéthylène basse densité)]] |
|||
|- |
|||
| [[Polyéthylène haute densité|{{Abréviation|PE-HD|PolyEthylene, High-Density}}]] || [[Fichier:PE-HD schematic.svg|Représentation schématique de PE-HD (polyéthylène haute densité)]] |
|||
|- |
|||
| [[Polyéthylène basse densité linéaire|{{Abréviation|PE-LLD|PolyEthylene, Linear Low-Density}}]] || [[Fichier:PE-LLD schematic.svg|Représentation schématique de PE-LLD (polyéthylène basse densité linéaire)]] |
|||
|} |
|||
== Catalyseurs == |
== Catalyseurs == |
||
La première génération de catalyseurs est obtenue en faisant réagir ''in situ'' du [[tétrachlorure de titane]] et du [[triéthylaluminium]], ce qui forme du β-TiCl<sub>3</sub>, ensuite transformé en γ-TiCl<sub>3</sub><ref name="H925"/>. |
|||
La plupart des catalyseurs Ziegler-Natta et tous leurs cocatalyseurs [[Alkyle|alkyl]][[aluminium]] réagissent au contact de l'air, les [[Composé organoaluminique|composés organoaluminiques]] utilisés étant [[Pyrophoricité|pyrophoriques]]. Ces substances sont par conséquent toujours préparées et manipulées sous atmosphère inerte. |
|||
La deuxième génération de catalyseur permet d'obtenir la forme δ du [[trichlorure de titane]], plus [[Spécificité et sélectivité|stéréosélective]]<ref name="H925"/>. |
|||
=== Hétérogènes === |
|||
Depuis les années 1980, une troisième génération de catalyseurs utilise du tétrachlorure de titane supporté sur du [[chlorure de magnésium]], ce qui favorise la croissance épitaxiale du cristal de catalyseur<ref name="H925"/>. |
|||
Les dernières générations de catalyseurs consistent en des [[complexe de coordination|complexes]] de métaux de transition de type zirconium<ref name="H926"/>. |
|||
La première génération de [[catalyse]]urs Ziegler-Natta pour la [[polymérisation]] des [[alcène]]s, à base de [[titane]] (et parfois de [[vanadium]]), peut être divisée en deux groupes : |
|||
* catalyseurs permettant l'[[Homopolymère|homopolymérisation]] de l'[[éthylène]] et la [[Copolymère|copolymérisation]] éthylène/{{nobr|alcène-1}} conduisant à des copolymères à faible teneur en alcènes terminaux ([[Polyéthylène basse densité linéaire|{{Abréviation|PE-LLD|PolyEthylene, Linear Low-Density}}]] de 2 à 4 % [[Mole (unité)|molaires]]) ; |
|||
* catalyseurs permettant la production d'alcènes terminaux [[Tacticité|isotactiques]]. |
|||
Ces deux groupes de catalyseurs ne se superposent quasiment pas car ils répondent à des spécifications très différentes. Les catalyseurs disponibles commercialement sont liés à un solide présentant une [[surface spécifique]] élevée. Le [[tétrachlorure de titane]] {{fchim|TiCl|4}} et le [[Chlorure de titane(III)|trichlorure de titane]] {{fchim|TiCl|3}} donnent tous les deux des catalyseurs actifs<ref name="978-0-85404-622-5">{{en}} Anthony F. Hill, ''Organotransition Metal Chemistry'', Royal Society of Chemistry, 2002, {{p.|136-139}}. {{ISBN|978-0-85404-622-5}}</ref>{{,}}<ref name="978-0080557991">{{en}} Yury Kissin, ''Alkene Polymerization Reactions with Transition Metal Catalysts'', Elsevier, 2008, {{chap.|4}}. {{ISBN|978-0080557991}}</ref>. Le [[chlorure de magnésium]] {{fchim|MgCl|2}} est le support dans la plupart des cas. On fait également intervenir le plus souvent un troisième élément sous forme d'un matériau porteur (''{{lang|en|carrier}}'' en anglais) qui détermine la taille et la forme des particules de catalyseur. Il s'agit généralement de sphères de [[Dioxyde de silicium|silice]] {{fchim|SiO|2}} [[Matière amorphe|amorphe]] {{Lien|langue=en|trad=Microporous material|fr=Matériau microporeux|texte=microporeuse}} d'un diamètre de {{unité|30|à=40|mm}}. Les [[Composé chimique|composés]] de [[titane]] et le [[Chlorure de magnésium|{{fchim|MgCl|2}}]] sont logés dans les [[Porosité|pores]] des billes de silice. Ces catalyseurs sont tous activés avec des [[Composé organoaluminique|composés organoaluminiques]] tels que le [[triéthylaluminium]] {{fchim|Al|2|(CH|2|CH|3|)|6}}<ref name="978-0080557991"/>. |
|||
Tous les catalyseurs Ziegler-Natta hétérogènes pour la polymérisation du [[propylène]] et des alcènes terminaux supérieurs sont préparés avec [[Tétrachlorure de titane|{{fchim|TiCl|4}}]] comme principe actif et [[Chlorure de magnésium|{{fchim|MgCl|2}}]] comme support. Un adjuvant [[Composé organique|organique]], généralement un [[ester]] de [[Polyacide|diacide]] [[Composé aromatique|aromatique]] ou un [[Éther-oxyde|diéther]], réagit aussi bien avec les ingrédients [[Composé inorganique|inorganiques]] solides des catalyseurs qu'avec les cocatalyseurs organoaluminiques<ref name="978-0080557991"/>. De tels catalyseurs agissent sur le propylène et les alcènes terminaux supérieurs pour produire des polymères isotactiques très [[Taux de cristallinité|cristallins]]<ref name="978-0-85404-622-5"/>{{,}}<ref name="978-0080557991"/>. |
|||
=== Homogènes === |
|||
Une seconde génération de [[catalyse]]urs Ziegler-Natta est soluble dans le [[milieu réactionnel]]. Ce sont traditionnellement des dérivés de [[métallocène]]s, mais ces catalyseurs se diversifient significativement jusqu'à inclure des [[Ligand (chimie)|ligands]] [[Azote|azotés]]. Les [[Catalyseur de Kaminsky|catalyseurs de Kaminsky]] les plus simples ont pour [[Formule chimique|formule]] générale {{fchim|[[Cyclopentadiényle|Cp]]|2|[[Groupe 4 du tableau périodique|M]][[Chlore|Cl]]|2}}, où {{nobr|[[Métal de transition|M]] {{=}} [[Zirconium|Zr]]}} ou [[Hafnium|Hf]] (respectivement [[dichlorure de zirconocène]] ou [[dichlorure d'hafnocène]]). Ce sont des dérivés de métallocènes parfois complexes<ref name="978-0-85404-622-5"/>{{,}}<ref name="978-0080557991"/>{{,}}<ref name="978-0198558132">{{en}} M. Bochmann, ''Organometallics 1, Complexes with Transition Metal-Carbon {{math|σ}}-Bonds'', Oxford University Press, 1994, {{p.|69-71}}. {{ISBN|978-0198558132}}</ref>{{,}}<ref name="10.1021/cr9804700"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Helmut G. Alt et Alexander Köppl |
|||
| titre = Effect of the Nature of Metallocene Complexes of Group {{IV}} Metals on Their Performance in Catalytic Ethylene and Propylene Polymerization |
|||
| périodique = Chemical Reviews |
|||
| volume = 100 |
|||
| numéro = 4 |
|||
| jour = 14 |
|||
| mois = mars |
|||
| année = 2000 |
|||
| pages = 1205-1222 |
|||
| url texte = https://pubs.acs.org/doi/10.1021/cr9804700 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1021/cr9804700 |
|||
| pmid = 11749264 |
|||
| bibcode = |
|||
}}.</ref> activés par un [[méthylaluminoxane]] (MAO) de type {{nobr|−{{fchim|[O−Al(CH|3|)]|{{mvar|n}}}}−}}, qui permettent d'atteindre un niveau de contrôle microstructural incacessible aux catalyseurs hétérogènes<ref name="10.1002/anie.199511431"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Hans H. Brintzinger, David Fischer, Rolf Mülhaupt, Bernhard Rieger et Robert M. Waymouth |
|||
| titre = Stereospecific Olefin Polymerization with Chiral Metallocene Catalysts |
|||
| périodique = Angewandte Chemie International Edition |
|||
| volume = 13 |
|||
| numéro = 11 |
|||
| jour = 16 |
|||
| mois = juin |
|||
| année = 1995 |
|||
| pages = 1143-1170 |
|||
| url texte = https://onlinelibrary.wiley.com/doi/10.1002/anie.199511431 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1002/anie.199511431 |
|||
| pmid = |
|||
| bibcode = |
|||
}}.</ref>. |
|||
<gallery mode="packed" heights="150px" caption="[[Catalyseur de Kaminsky|Catalyseurs de Kaminsky]]."> |
|||
Fichier:Metallocenes3.png|{{Centrer|L'utilisation de [[métallocène]]s ('''1''') pour la [[polymérisation]] du [[propylène]] donne du [[polypropylène]] [[atactique]], tandis que les systèmes catalytiques à base de métallocènes à [[Indène|indényles]] pontés de [[Symétrie moléculaire|symétrie]] {{nobr|''C''{{ind|2}}}} ('''2''') ou à [[Fluorène|fluorényl]]-[[cyclopentadiényle]] pontés de symétrie {{nobr|''C''{{ind|s}}}} ('''3''') produisent des [[polymère]]s respectivement [[isotactique]]s et [[syndiotactique]]s.}} |
|||
Fichier:MAO-repeating-unit-2D.png|{{Centrer|[[Méthylaluminoxane]].}} |
|||
</gallery> |
|||
Une troisième génération de catalyseurs Ziegler-Natta, dite ''post-métallocène'', fait généralement intervenir des [[Ligand (chimie)|ligands]] {{Lien|langue=en|trad=Diimine|fr=Diimine|texte={{nobr|{{math|α}}-diimine}}}} électriquement neutres et [[Encombrement stérique|stériquement volumineux]]<ref name="10.1016/j.progpolymsci.2006.11.001"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Gregory J. Domski, Jeffrey M. Rose, Geoffrey W. Coates, Andrew D. Bolig et Maurice Brookhart |
|||
| titre = Living alkene polymerization: New methods for the precision synthesis of polyolefins |
|||
| périodique = Progress in Polymer Science |
|||
| volume = 32 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = janvier |
|||
| année = 2007 |
|||
| pages = 30-92 |
|||
| url texte = https://www.sciencedirect.com/science/article/pii/S0079670006001341 |
|||
| consulté le = 26 décembre 2022 |
|||
| doi = 10.1016/j.progpolymsci.2006.11.001 |
|||
| pmid = |
|||
| bibcode = |
|||
}}.</ref> [[Complexe de coordination|coordonnés]] à divers [[Métal de transition|métaux de transition]] tels que le [[fer]], le [[nickel]] ou le [[palladium]], ces [[Complexe (chimie)|complexes]] étant activés par du méthylaluminoxane (MAO), comme pour les catalyseurs à métallocènes : |
|||
<gallery mode="packed" heights="120px" caption="{{Lien|langue=en|trad=Post-metallocene catalyst|fr=Catalyseur post-métallocène|texte=Catalyseurs post-métallocènes}}."> |
|||
Fichier:Iron tridentate.png|{{Centrer|[[Catalyse]]ur à [[Ligand (chimie)|ligand]] {{Lien|langue=en|trad=Diiminopyridine|fr=diiminopyridine}}.}} |
|||
Fichier:Nickel bidentate.png|{{Centrer|Exemple de ligand {{Lien|langue=en|trad=Diimine|fr=Diimine|texte={{nobr|{{math|α}}-diimine}}}} neutre.}} |
|||
Fichier:Trippy-nickel-catalyst.png|{{Centrer|Ligand [[Substituant|substitué]] très accepteur d'électrons<ref name="10.1002/anie.202013854">{{Article | langue = en | nom1 = Mateusz Janeta, Julius X. Heidlas, Olafs Daugulis et Maurice Brookhart | titre = 2,4,6-Triphenylpyridinium: A Bulky, Highly Electron-Withdrawing Substituent That Enhances Properties of Nickel({{II}}) Ethylene Polymerization Catalysts | périodique = Angewandte Chemie International Edition | volume = 60 | numéro = 9 | jour = 23 | mois = février | année = 2021 | pages = 4566-4569 | url texte = https://onlinelibrary.wiley.com/doi/10.1002/anie.202013854 | consulté le = 26 décembre 2022 | doi = 10.1002/anie.202013854 | pmid = 33230900 | s2cid = 227159941}}.</ref>.}} |
|||
Fichier:Nickel monoanionic.png|{{Centrer|Ligand [[anion]]ique à [[base de Schiff]].}} |
|||
</gallery> |
|||
== Mécanisme == |
== Mécanisme == |
||
La structure des centre actifs des [[catalyse]]urs Ziegler-Natta est bien établie pour ceux à [[métallocène]]s. Un [[Complexe de coordination|complexe]] simplifié comme le [[dichlorure de zirconocène]] {{fchim|[[Cyclopentadiényle|Cp]]|2|[[Zirconium|Zr]][[Chlore|Cl]]|2}} est un [[Cycle catalytique|précatalyseur]] typique. Il ne réagit pas avec les [[alcène]]s, mais les deux [[halogénure]]s réagissent avec le [[méthylaluminoxane]] (MAO) pour former un [[cation]] métallocénium {{fchim|Cp|2|{{Overset|+|Zr}}CH|3}} qui utilise certains dérivés du MAO comme [[contre-ion]]s. Le [[polymère]] croît par insertions multiples sur les [[Liaison double|doubles liaisons]] {{nobr|[[Carbone|C]]{{=}}[[Carbone|C]]}} de [[molécule]]s d'alcènes terminaux au niveau de la liaison {{nobr|[[Zirconium|Zr]]−[[Carbone|C]]}} du cation : |
|||
== Applications industrielles == |
|||
Au niveau industriel, la catalyse de Ziegler-Natta est utilisée pour la fabrication par [[polymérisation coordinative]] du [[polyéthylène haute densité]] (PE-HD), du [[polyéthylène à basse densité linéaire]] (PE-LLD), du [[polyéthylène à très basse densité]] (PE-VLD) et du polypropylène isotactique (iPP)<ref>Marc Carrega, « Aide-mémoire - Matières plastiques », {{Coll.|Aide-Mémoire}}, Dunod/''L'Usine nouvelle'', 2009, {{2e}}{{éd.}}, 256{{nb p.}}</ref>. |
|||
[[Fichier:ZNonSingleSite.png|redresse=3|centré|frameless|Schéma simplifié de la polymérisation de l'éthylène par un zirconocène.]] |
|||
Plusieurs milliers d'insertions se produisent à chaque centre actif, ce qui donne de longues chaînes de polymère liées à ces centres. La croissance [[Stéréospécificité|stéréospécifique]] de polymères est décrite par le {{Lien|langue=en|trad=Cossee–Arlman mechanism|fr=mécanisme de Cossee-Arlman}}. Ce modèle considère que les polymères croissent par coordination des alcènes sur un site vacant de l'atome de titane suivie par l'insertion d'une double liaison {{nobr|[[Carbone|C]]{{=}}[[Carbone|C]]}} sur la liaison {{nobr|[[Zirconium|Zr]]−[[Carbone|C]]}} du centre actif<ref name="978-1483223865"/>{{,}}<ref name="978-3527281640">{{en}} Christoph Elschenbroich et Albrecht Salzer, ''Organometallics: A Concise Introduction'', Wiley-VCH, 1992, {{p.|423-425}}. {{ISBN|978-3527281640}}</ref>. |
|||
== Applications == |
|||
Au niveau industriel, la catalyse de Ziegler-Natta est utilisée pour la production par [[polymérisation coordinative]] du [[polyéthylène haute densité]] (PE-HD), du [[polyéthylène basse densité linéaire]] (PE-LLD), du [[polyéthylène à très basse densité]] (PE-VLD) et du polypropylène isotactique (iPP)<ref>Marc Carrega, « Aide-mémoire - Matières plastiques », {{Coll.|Aide-Mémoire}}, Dunod/''L'Usine nouvelle'', 2009, {{2e}}{{éd.}}, 256{{nb p.}}</ref>. |
|||
== Notes et références == |
== Notes et références == |
||
{{Références|références= |
|||
{{Références}} |
|||
<ref name="H925">{{Harvsp|Housecroft|Sharpe|2010|p=925}}</ref> |
|||
<ref name="H926">{{Harvsp|Housecroft|Sharpe|2010|p=926}}</ref> |
|||
}} |
|||
== Bibliographie == |
== Bibliographie == |
||
*{{ouvrage|titre=Chimie inorganique|prénom1=Catherine|nom1=Housecroft|prénom2=Alan|nom2=Sharpe|éditeur=De Boeck|lien éditeur=De Boeck|traducteur=André Pousse|mois=septembre|année=2010|passage=|isbn=978-2-8041-6218-4}} |
|||
*{{Ouvrage|langue=fr|langue originale=en|prénom1=Catherine|nom1=Housecroft|prénom2=Alan|nom2=Sharpe|traducteur=André Pousse|titre=Chimie inorganique|éditeur=[[De Boeck]]|lieu=Bruxelles/Paris|année=2010|mois=septembre|pages totales=1097|isbn=978-2-8041-6218-4|lire en ligne=https://books.google.com/books?id=Q00mDwAAQBAJ&printsec=frontcover}} |
|||
{{Palette|Chimie organométallique}} |
|||
{{Chimie}} |
|||
{{Palette|Chimie organométallique|Matériaux polymères}} |
|||
{{Portail|Chimie}} |
|||
[[Catégorie:Procédé industriel]] |
|||
[[Catégorie:Catalyse hétérogène|Ziegler-Natta]] |
[[Catégorie:Catalyse hétérogène|Ziegler-Natta]] |
||
[[Catégorie:Catalyse homogène|Ziegler-Natta]] |
|||
[[Catégorie:Synthèse des polymères]] |
|||
[[Catégorie:Complexe]] |
|||
Dernière version du 25 novembre 2023 à 10:19
La catalyse de Ziegler-Natta, ou procédé Ziegler-Natta, est un procédé industriel de production de polyoléfines à tacticité contrôlée. Mis au point par Karl Ziegler et Giulio Natta au début des années 1950, ce procédé leur valut le prix Nobel de chimie en 1963[1]. Il repose historiquement sur la polymérisation coordinative à l'aide de catalyseurs mixtes formés d'un composé organométallique des groupes I, II ou III du groupe principal, c'est-à-dire des groupes 1, 2 et 13 du tableau périodique (par exemple le triéthylaluminium Al2(C2H5)6) activant un composé de métal de transition, principalement des groupes 4, 5 et 6 (par exemple le tétrachlorure de titane TiCl4)[2]. Ce procédé de catalyse hétérogène a par la suite connu plusieurs optimisations, les générations plus récentes de catalyseurs Ziegler-Natta faisant par exemple intervenir des complexes de zirconium ou d'hafnium à ligands ansa-métallocènes de cyclopentadiényle, fluorényle, indényle, etc. activés par un méthylaluminoxane (catalyseurs de Kaminsky) mais peuvent aussi faire appel à des ligands multidentés à base d'oxygène et d'azote[3] dans le cadre d'une catalyse homogène. Le procédé Ziegler-Natta trouve une application technique dans la synthèse industrielle du polyéthylène et du polypropylène, particulièrement dans la polymérisation d'alcènes terminaux (éthylène et alcènes à groupe vinyle) :
- n CH2=CHR ⟶ –[CH2–CHR]n –.
Histoire[modifier | modifier le code]
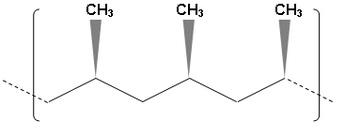
Le polyéthylène est produit par polymérisation radicalaire depuis 1938 à des pressions atteignant 300 MPa et des températures allant jusqu'à 300 °C. Au début des années 1950, une équipe de la Phillips Petroleum Company découvrit des catalyseurs au chrome permettant la polymérisation de l'éthylène à basse température, ce qui aboutit à la mise au point du catalyseur Phillips. En 1953, Karl Ziegler découvrit que l'éthylène pouvait être polymérisé en polyéthylène à des pressions et des températures proches des conditions ambiantes normales à l'aide de tétrachlorure de titane TiCl4 activé au chlorure de diéthylaluminium [(CH3CH2)2Al(µ-Cl)]2[4]. Le polyéthylène produit de cette manière, dit polyéthylène haute densité (PE-HD), avait des propriétés mécaniques différentes de celles du polyéthylène produit jusqu'alors par polymérisation radicalaire à pression et températures élevées, dit polyéthylène basse densité (PE-LD), car il était linéaire et non pas ramifié, d'où un taux de cristallinité plus élevée, ce qui lui conférait une dureté et une raideur également plus élevées. Ce procédé fut mis en œuvre industriellement quelques mois après sa découverte[5]. Giulio Natta utilisa du trichlorure de titane α-TiCl3 activé par du triéthylaluminium Al2(CH2CH3)6 pour obtenir le premier polypropylène isotactique[6].
- Tacticité du polypropylène.
-
Isotactique.
-
Syndiotactique.
Dans les années 1970, le chlorure de magnésium MgCl2 se révéla être un activateur très efficace des catalyseurs à base de titane tels que TiCl4[7], au point qu'il n'était plus nécessaire d'éliminer les résidus de catalyseur du produit final. Ceci a permis la commercialisation de polyéthylène basse densité linéaire (PE-LLD) et le développement de copolymères non cristallins[8]. À titre indicatif, le degré de ramification de ces différents types de polyéthylène peut être schématisé de la façon suivante :
| PE-LD | 
|
| PE-HD | |
| PE-LLD |
Catalyseurs[modifier | modifier le code]
La plupart des catalyseurs Ziegler-Natta et tous leurs cocatalyseurs alkylaluminium réagissent au contact de l'air, les composés organoaluminiques utilisés étant pyrophoriques. Ces substances sont par conséquent toujours préparées et manipulées sous atmosphère inerte.
Hétérogènes[modifier | modifier le code]
La première génération de catalyseurs Ziegler-Natta pour la polymérisation des alcènes, à base de titane (et parfois de vanadium), peut être divisée en deux groupes :
- catalyseurs permettant l'homopolymérisation de l'éthylène et la copolymérisation éthylène/alcène-1 conduisant à des copolymères à faible teneur en alcènes terminaux (PE-LLD de 2 à 4 % molaires) ;
- catalyseurs permettant la production d'alcènes terminaux isotactiques.
Ces deux groupes de catalyseurs ne se superposent quasiment pas car ils répondent à des spécifications très différentes. Les catalyseurs disponibles commercialement sont liés à un solide présentant une surface spécifique élevée. Le tétrachlorure de titane TiCl4 et le trichlorure de titane TiCl3 donnent tous les deux des catalyseurs actifs[9],[10]. Le chlorure de magnésium MgCl2 est le support dans la plupart des cas. On fait également intervenir le plus souvent un troisième élément sous forme d'un matériau porteur (carrier en anglais) qui détermine la taille et la forme des particules de catalyseur. Il s'agit généralement de sphères de silice SiO2 amorphe microporeuse (en) d'un diamètre de 30 à 40 mm. Les composés de titane et le MgCl2 sont logés dans les pores des billes de silice. Ces catalyseurs sont tous activés avec des composés organoaluminiques tels que le triéthylaluminium Al2(CH2CH3)6[10].
Tous les catalyseurs Ziegler-Natta hétérogènes pour la polymérisation du propylène et des alcènes terminaux supérieurs sont préparés avec TiCl4 comme principe actif et MgCl2 comme support. Un adjuvant organique, généralement un ester de diacide aromatique ou un diéther, réagit aussi bien avec les ingrédients inorganiques solides des catalyseurs qu'avec les cocatalyseurs organoaluminiques[10]. De tels catalyseurs agissent sur le propylène et les alcènes terminaux supérieurs pour produire des polymères isotactiques très cristallins[9],[10].
Homogènes[modifier | modifier le code]
Une seconde génération de catalyseurs Ziegler-Natta est soluble dans le milieu réactionnel. Ce sont traditionnellement des dérivés de métallocènes, mais ces catalyseurs se diversifient significativement jusqu'à inclure des ligands azotés. Les catalyseurs de Kaminsky les plus simples ont pour formule générale Cp2MCl2, où M = Zr ou Hf (respectivement dichlorure de zirconocène ou dichlorure d'hafnocène). Ce sont des dérivés de métallocènes parfois complexes[9],[10],[11],[12] activés par un méthylaluminoxane (MAO) de type −[O−Al(CH3)]n−, qui permettent d'atteindre un niveau de contrôle microstructural incacessible aux catalyseurs hétérogènes[13].
- Catalyseurs de Kaminsky.
-
L'utilisation de métallocènes (1) pour la polymérisation du propylène donne du polypropylène atactique, tandis que les systèmes catalytiques à base de métallocènes à indényles pontés de symétrie C2 (2) ou à fluorényl-cyclopentadiényle pontés de symétrie Cs (3) produisent des polymères respectivement isotactiques et syndiotactiques.
Une troisième génération de catalyseurs Ziegler-Natta, dite post-métallocène, fait généralement intervenir des ligands α-diimine (en) électriquement neutres et stériquement volumineux[14] coordonnés à divers métaux de transition tels que le fer, le nickel ou le palladium, ces complexes étant activés par du méthylaluminoxane (MAO), comme pour les catalyseurs à métallocènes :
- Catalyseurs post-métallocènes (en).
-
Ligand anionique à base de Schiff.
Mécanisme[modifier | modifier le code]
La structure des centre actifs des catalyseurs Ziegler-Natta est bien établie pour ceux à métallocènes. Un complexe simplifié comme le dichlorure de zirconocène Cp2ZrCl2 est un précatalyseur typique. Il ne réagit pas avec les alcènes, mais les deux halogénures réagissent avec le méthylaluminoxane (MAO) pour former un cation métallocénium Cp2CH3 qui utilise certains dérivés du MAO comme contre-ions. Le polymère croît par insertions multiples sur les doubles liaisons C=C de molécules d'alcènes terminaux au niveau de la liaison Zr−C du cation :

Plusieurs milliers d'insertions se produisent à chaque centre actif, ce qui donne de longues chaînes de polymère liées à ces centres. La croissance stéréospécifique de polymères est décrite par le mécanisme de Cossee-Arlman (en). Ce modèle considère que les polymères croissent par coordination des alcènes sur un site vacant de l'atome de titane suivie par l'insertion d'une double liaison C=C sur la liaison Zr−C du centre actif[6],[16].
Applications[modifier | modifier le code]
Au niveau industriel, la catalyse de Ziegler-Natta est utilisée pour la production par polymérisation coordinative du polyéthylène haute densité (PE-HD), du polyéthylène basse densité linéaire (PE-LLD), du polyéthylène à très basse densité (PE-VLD) et du polypropylène isotactique (iPP)[17].
Notes et références[modifier | modifier le code]
- (en) « The Nobel Prize in Chemistry 1963 », sur nobelprize.org (consulté le ).
- (en) Adriano G. Fisch, « Ziegler-Natta Catalysts », Kirk-Othmer Encyclopedia of Chemical Technology, (DOI 10.1002/0471238961.2609050703050303.a01.pub2, lire en ligne).
- (en) Ray Hoff et Robert T. Mathers, Handbook of Transition Metal Polymerization Catalysts, John Wiley & Sons, 2010 (DOI 10.1002/9780470504437). (ISBN 978-0470137987)
- (de) Karl Ziegler, E. Holzkamp, H. Breil et H. Martin, « Polymerisation von Äthylen und anderen Olefinen », Angwandte Chemie, vol. 67, no 16, , p. 426-426 (DOI 10.1002/ange.19550671610, Bibcode 1955AngCh..67..426Z, lire en ligne).
- (en) Ludwig L. Böhm, « The Ethylene Polymerization with Ziegler Catalysts: Fifty Years after the Discovery », Angewandte Chemie International Edition, vol. 42, no 41, , p. 5010-5030 (PMID 14595622, DOI 10.1002/anie.200300580, lire en ligne).
- (en) Giulio Natta et Ferdinando Danusso, Stereoregular Polymers and Stereospecific Polymerizations: The Contributions of Giulio Natta and His School to Polymer Chemistry, vol. 1, Pergamon Press, 1967. (ISBN 978-1483223865)
- (en) Norio Kashiwa, « The discovery and progress of MgCl2-supported TiCl4 catalysts », Journal of Polymer Science A, vol. 42, no 1, , p. 1-8 (DOI 10.1002/pola.10962, lire en ligne).
- (en) Thomas E. Nowlin, Robert I. Mink et Yury V. Kissin, « Supported Magnesium/Titanium-Based Ziegler Catalysts for Production of Polyethylene », Handbook of Transition Metal Polymerization Catalysts, , p. 131-155 (DOI 10.1002/9780470504437.ch6, lire en ligne).
- (en) Anthony F. Hill, Organotransition Metal Chemistry, Royal Society of Chemistry, 2002, p. 136-139. (ISBN 978-0-85404-622-5)
- (en) Yury Kissin, Alkene Polymerization Reactions with Transition Metal Catalysts, Elsevier, 2008, chap. 4. (ISBN 978-0080557991)
- (en) M. Bochmann, Organometallics 1, Complexes with Transition Metal-Carbon σ-Bonds, Oxford University Press, 1994, p. 69-71. (ISBN 978-0198558132)
- (en) Helmut G. Alt et Alexander Köppl, « Effect of the Nature of Metallocene Complexes of Group IV Metals on Their Performance in Catalytic Ethylene and Propylene Polymerization », Chemical Reviews, vol. 100, no 4, , p. 1205-1222 (PMID 11749264, DOI 10.1021/cr9804700, lire en ligne).
- (en) Hans H. Brintzinger, David Fischer, Rolf Mülhaupt, Bernhard Rieger et Robert M. Waymouth, « Stereospecific Olefin Polymerization with Chiral Metallocene Catalysts », Angewandte Chemie International Edition, vol. 13, no 11, , p. 1143-1170 (DOI 10.1002/anie.199511431, lire en ligne).
- (en) Gregory J. Domski, Jeffrey M. Rose, Geoffrey W. Coates, Andrew D. Bolig et Maurice Brookhart, « Living alkene polymerization: New methods for the precision synthesis of polyolefins », Progress in Polymer Science, vol. 32, no 1, , p. 30-92 (DOI 10.1016/j.progpolymsci.2006.11.001, lire en ligne).
- (en) Mateusz Janeta, Julius X. Heidlas, Olafs Daugulis et Maurice Brookhart, « 2,4,6-Triphenylpyridinium: A Bulky, Highly Electron-Withdrawing Substituent That Enhances Properties of Nickel(II) Ethylene Polymerization Catalysts », Angewandte Chemie International Edition, vol. 60, no 9, , p. 4566-4569 (PMID 33230900, DOI 10.1002/anie.202013854, S2CID 227159941, lire en ligne).
- (en) Christoph Elschenbroich et Albrecht Salzer, Organometallics: A Concise Introduction, Wiley-VCH, 1992, p. 423-425. (ISBN 978-3527281640)
- Marc Carrega, « Aide-mémoire - Matières plastiques », coll. « Aide-Mémoire », Dunod/L'Usine nouvelle, 2009, 2e éd., 256 p.
Bibliographie[modifier | modifier le code]
- Catherine Housecroft et Alan Sharpe (trad. de l'anglais par André Pousse), Chimie inorganique, Bruxelles/Paris, De Boeck, , 1097 p. (ISBN 978-2-8041-6218-4, lire en ligne)





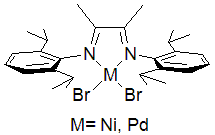
![Ligand substitué très accepteur d'électrons[15].](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Trippy-nickel-catalyst.png/230px-Trippy-nickel-catalyst.png)
