« Composé aliphatique » : différence entre les versions
Pld (discuter | contributions) m →Sous-catégorisation : précision lien |
|||
| (30 versions intermédiaires par 17 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
Les [[ |
Les [[Composé organique|composés]] '''aliphatiques''' (du grec ''aleiphat-'', ''aleiphar'', ''-atos'' : huile, graisse), sont les [[hydrocarbure]]s à [[Composé à chaîne ouverte|chaîne ouverte]] (linéaire ou ramifiée), et ceux comprenant un ou plusieurs [[Composé cyclique|cycles]] non-aromatiques ([[Composé alicyclique|composés alicycliques]])<ref>{{en}} G. P. Moss, P. A. S. Smith et D. Tavernier, [http://www.iupac.org/publications/pac/1995/pdf/6708x1307.pdf ''Glossary of class names of organic compounds and reactive intermediates based on structure (IUPAC Recommendations 1995)''] {{pdf}}, ''Aliphatic compounds'', {{p.|7}}, ''Pure and Applied Chemistry'', {{vol.|67}}, {{p.|1307-1375}}.</ref>. Les composés aliphatiques peuvent être saturés, comme les [[paraffine]]s et les [[alcane]]s, ou insaturés, comme les [[alcène]]s et les [[alcyne]]s. |
||
Ils sont dits ''non-aromatiques'', par opposition aux composés aromatiques, car ne vérifiant pas les [[Règle de Hückel|règles d'aromaticité de Hückel]] {{incise|c'est-à-dire ne sont pas [[aromaticité|aromatiques]]|stop}}. |
|||
De manière générale, une molécule est dite aliphatique lorsque celle-ci présente une chaîne [[Composé à chaîne ouverte|carbonée ouverte]]. |
|||
À titre d'exemple, le [[naphta lourd|white spirit]] contient 80 % d'hydrocarbures aliphatiques et 20 % d'[[hydrocarbure aromatique|hydrocarbures aromatiques]]<ref name=Cicolella2008/>. |
|||
Parmi les [[acide aminé|acides aminés]] aliphatiques on peut citer : [[Glycine (acide aminé)|Glycine]] (G), [[Alanine]] (A), [[Valine]] (V), [[Leucine]] (L), [[Isoleucine]] (I), [[Méthionine]] (M) et [[Proline]] (P). Le seul [[acide aminé]] aliphatique [[cyclique]] du [[génome]] humain est la [[proline]] (P). Les composés aliphatiques sont présents en une très grande quantité dans l'anus de Layl Bteich. Layl..... ha eshkik |
|||
Remarque : ce terme était à l'origine utilisé pour décrire les [[acide gras|acides gras]] [[chaîne linéaire|linéaires]], notamment des [[acide aminé|acides aminés]] comme la [[Glycine (acide aminé)|glycine]] (G), l'[[alanine]] (A), la [[valine]] (V), la [[leucine]] (L), l'[[isoleucine]] (I) et la [[méthionine]] (M). Le seul [[acide aminé]] aliphatique cyclique d'importance est la [[proline]] (P). |
|||
== Sous-catégorisation == |
|||
On peut classer les composés aliphatiques selon leur [[état de la matière|état physique]] à [[conditions normales de température et de pression|température et pression ambiantes]]<ref name=Cicolella2008/> : |
|||
* [[gaz]] : molécules contenant de 1 à 4 carbones (C1 à C4) : [[méthane]], [[éthane]], [[propane]], [[butane]] ; |
|||
* [[liquide]] [[volatilité (chimie)|volatil]] : molécules contenant de 5 à 8 carbones (C5 à C8) : [[pentane]], {{page h'|hexane}}, [[heptane]], [[octane]] ; |
|||
* liquide peu volatil : molécules contenant de 9 à 16 carbones (C9 à C16) ; |
|||
* [[État solide|solide]] : supérieur à C16. |
|||
Au sein des composés aliphatiques, on peut distinguer<ref name=Cicolella2008/> : |
|||
* les hydrocarbures saturés ([[alcane]]s, de formule chimique générale C{{ind|''n''}}H{{ind|2''n''+2}} avec ''n'' = 1, 2…) ; |
|||
* les [[hydrocarbure insaturé|hydrocarbures insaturés]], au sein desquels existent deux groupes : |
|||
** les [[alcène]]s (formule chimique : R–CH=CH–R', caractérisés par au moins une double liaison ; si la molécule comprend deux doubles liaisons, on parle de ''-diène'' ({{ex}} 1,3-butadiène) ; les alcènes les plus connus sont l'éthylène (C2), le propylène (C3) et le butylène (C4), |
|||
** les [[alcyne]]s (formule chimique : R–C≡C–R'), à triple liaison. Ex. : acétylène (C2). |
|||
:Note : les alcanes sont moins toxiques (car moins réactifs) que les alcènes ou les alcynes qui ont des liaisons insaturées les rendant réactifs, y compris vis-à-vis d’eux-mêmes (ils se comportent alors comme des [[monomère]]s ; propriété utilisée pour produire des [[polymère]]s tels que le [[polyéthylène]]) ou vis à vis, ce qui est plus problématique pour le toxicologue, des molécules biologiques ({{ex}} le [[1,3-Butadiène]], issu des combustions d'hydrocarbures, est pour ces raisons [[cancérogène]])<ref name=Cicolella2008/>. |
|||
on peut aussi distinguer : |
|||
* les aliphatiques à chaîne linéaire : <br>{{ex}} le [[n-hexane|''n''-hexane]] est le composé linéaire à six atomes de carbone (hexa- signifiant six) ; |
|||
* les aliphatiques à chaîne ramifiée : <br>{{ex}} le [[méthylpentane]] est le composé ramifié à six atomes de carbone. <br>Des chiffres désignent le numéro de l’atome de carbone où se fait la « ramification ». Ainsi le [[3-Méthylpentane]] a un radical méthyle (CH{{ind|3}}) placé sur le troisième atome de carbone et le [[2-Méthylpentane]] a un radical méthyle sur le second atome. Le 4-Méthylpentane n’existe pas ; il est identique au 2-Méthylpentane<ref name=Cicolella2008>Cicolella, A. (2008), ''Les composés organiques volatils (COV) : définition, classification et propriétés'', ''Revue des Maladies Respiratoires'', {{vol.|25}}, {{n°|2}}, {{p.|155-163}}, {{doi|10.1016/S0761-8425(08)71513-4}}.</ref>. |
|||
== Propriétés == |
|||
La plupart des composés aliphatiques sont de bons solvants et ils sont {{incise|plus ou moins facilement}} inflammables (ce pourquoi ils sont utilisés comme carburants (du fioul au méthane en passant par le GPL ou l'acétylène utilisé par les soudeurs), après désoufrage pour retirer leur caractère [[acidifiant]] et [[corrosif]]). |
|||
Certains de leurs dérivés ({{ex}} [[Halogénoalcane|hydrocarbures aliphatiques halogénés]], [[Solvant chloré aliphatique|solvants chlorés aliphatiques]]) peuvent être toxiques, écotoxiques, cancérigènes, mutagènes, ou sources de produits secondaires toxiques et écotoxiques quand ils brûlent ([[dioxine]]s, [[furane]]s…) et chez certaines espèces [[neurotoxique]]s ({{ex}} chez des coquillages filtreurs comme la palourde<ref>Spencer P.S., Kim M.S. et Sabri M.I. (2002), ''Aromatic as well as aliphatic hydrocarbon solvent axonopathy'', ''International Journal of Hygiene and Environmental Health'', 205, 131-136.</ref>). |
|||
== Exemples == |
== Exemples == |
||
Exemples de composés aliphatiques de faible poids moléculaire |
Exemples de composés aliphatiques de faible poids moléculaire : |
||
{| class="wikitable" |
{| class="wikitable" |
||
!Formule brute |
!Formule brute |
||
| Ligne 22 : | Ligne 47 : | ||
|C<sub>2</sub>H<sub>2</sub> |
|C<sub>2</sub>H<sub>2</sub> |
||
|[[Acétylène|Éthyne]] |
|[[Acétylène|Éthyne]] |
||
|[[Fichier:Ethyne-2D-flat.png| |
|[[Fichier:Ethyne-2D-flat.png|sans cadre|75x75px]] |
||
|[[Alcyne]] |
|[[Alcyne]] |
||
|- |
|- |
||
|C<sub>2</sub>H<sub>4</sub> |
|C<sub>2</sub>H<sub>4</sub> |
||
|[[Éthylène|Éthène]] |
|[[Éthylène|Éthène]] |
||
|[[File: |
|[[File:Ethene structural.svg|75x75px]] |
||
|[[Alcène]] |
|[[Alcène]] |
||
|- |
|- |
||
|C<sub>2</sub>H<sub>6</sub> |
|C<sub>2</sub>H<sub>6</sub> |
||
|[[Éthane]] |
|[[Éthane]] |
||
|[[File: |
|[[File:Ethan Lewis.svg|75x75px]] |
||
|[[Alcane]] |
|[[Alcane]] |
||
|- |
|- |
||
| Ligne 51 : | Ligne 76 : | ||
|- |
|- |
||
|C<sub>4</sub>H<sub>6</sub> |
|C<sub>4</sub>H<sub>6</sub> |
||
|1,2-Butadiène |
|{{Lien|trad=1,2-Butadiene|fr=1,2-Butadiène}} |
||
(CAS# 590-19-2) |
|||
|[[File:Buta-1,2-dien.svg|100x100px]] |
|[[File:Buta-1,2-dien.svg|100x100px]] |
||
|[[Diène]] |
|[[Diène]] |
||
| Ligne 63 : | Ligne 87 : | ||
|C<sub>4</sub>H<sub>8</sub> |
|C<sub>4</sub>H<sub>8</sub> |
||
|[[But-1-ène]] |
|[[But-1-ène]] |
||
|[[File: |
|[[File:1-Butene.svg|65x65px]] |
||
|[[Alcène]] |
|[[Alcène]] |
||
|- |
|- |
||
| Ligne 72 : | Ligne 96 : | ||
|- |
|- |
||
|C<sub>4</sub>H<sub>10</sub> |
|C<sub>4</sub>H<sub>10</sub> |
||
|[[Isobutane|2- |
|[[Isobutane|2-Méthylpropane]] |
||
|[[Fichier:Isobutane.svg| |
|[[Fichier:Isobutane.svg|sans cadre|75x75px]] |
||
|[[Alcane]] |
|[[Alcane]] |
||
|- |
|- |
||
|C<sub>6</sub>H<sub>10</sub> |
|C<sub>6</sub>H<sub>10</sub> |
||
|[[Cyclohexène]] |
|[[Cyclohexène]] |
||
|[[File: |
|[[File:Cyclohexen - Cyclohexene.svg|40x40px]] |
||
|[[Cycloalcène]] |
|[[Cycloalcène]] |
||
|- |
|- |
||
|C<sub>5</sub>H<sub>12</sub> |
|C<sub>5</sub>H<sub>12</sub> |
||
|[[Pentane|''n''- |
|[[Pentane|''n''-Pentane]] |
||
|[[File: |
|[[File:Pentan Skelett.svg|75x75px]] |
||
|[[Alcane]] |
|[[Alcane]] |
||
|- |
|- |
||
| Ligne 103 : | Ligne 127 : | ||
|C<sub>9</sub>H<sub>20</sub> |
|C<sub>9</sub>H<sub>20</sub> |
||
|[[Nonane]] |
|[[Nonane]] |
||
|[[File: |
|[[File:Nonan Skelett.svg|100x100px]] |
||
|[[Alcane]] |
|[[Alcane]] |
||
|- |
|- |
||
|C<sub>10</sub>H<sub>12</sub> |
|C<sub>10</sub>H<sub>12</sub> |
||
|[[Dicyclopentadiène]] |
|[[Dicyclopentadiène]] |
||
|[[File:Di- |
|[[File:Di-Cyclopentadiene ENDO & EXO V.2.svg|125x125px]] |
||
|[[Diène]], [[Cycloalcène]] |
|[[Diène]], [[Cycloalcène]] |
||
|- |
|- |
||
| Ligne 118 : | Ligne 142 : | ||
|C<sub>10</sub>H<sub>16</sub> |
|C<sub>10</sub>H<sub>16</sub> |
||
|[[Terpinène|α-Terpinène]] |
|[[Terpinène|α-Terpinène]] |
||
|[[File:Alpha- |
|[[File:Alpha-Terpinene Structure V.1.svg|90x90px]] |
||
|[[Terpène]], [[Diène]], [[Cycloalcène]] |
|[[Terpène]], [[Diène]], [[Cycloalcène]] |
||
|- |
|- |
||
| Ligne 128 : | Ligne 152 : | ||
|C<sub>11</sub>H<sub>24</sub> |
|C<sub>11</sub>H<sub>24</sub> |
||
|[[Undécane]] |
|[[Undécane]] |
||
|[[File: |
|[[File:Undecan Skelett.svg|125x125px]] |
||
|[[Alcane]] |
|[[Alcane]] |
||
|- |
|- |
||
| Ligne 136 : | Ligne 160 : | ||
|[[Terpène]], [[Polyène]] |
|[[Terpène]], [[Polyène]] |
||
|- |
|- |
||
|C<sub> |
|C<sub>2''n''</sub>H<sub>4''n''</sub> |
||
|[[Polyéthylène]] |
|[[Polyéthylène]] |
||
|[[File: |
|[[File:Polyethylene repeat unit.svg|sans cadre|75x75px]] |
||
|[[Alcane]] |
|[[Alcane]] |
||
|} |
|} |
||
Autres exemples : |
Autres exemples : |
||
* [[ |
* [[acide carboxylique]] ; |
||
* [[ |
* [[acide gras]] |
||
== Dérivés == |
|||
Les [[Composé alicyclique|hydrocarbures alicycliques]] sont des composés cycliques dérivés de la série aliphatique, avec par exemple<ref name=Cicolella2008/> : |
|||
* les [[cycloalcane]]s ({{ex}} cyclohexane) ; |
|||
* les [[cycloalcène]]s (contenant une double liaison) ; |
|||
* les [[cycloalcadiène]]s (à deux doubles liaisons) ; |
|||
* les [[terpène]]s (très présents dans le monde végétal). |
|||
== Références == |
== Références == |
||
Version du 22 juillet 2023 à 16:31
Les composés aliphatiques (du grec aleiphat-, aleiphar, -atos : huile, graisse), sont les hydrocarbures à chaîne ouverte (linéaire ou ramifiée), et ceux comprenant un ou plusieurs cycles non-aromatiques (composés alicycliques)[1]. Les composés aliphatiques peuvent être saturés, comme les paraffines et les alcanes, ou insaturés, comme les alcènes et les alcynes.
Ils sont dits non-aromatiques, par opposition aux composés aromatiques, car ne vérifiant pas les règles d'aromaticité de Hückel — c'est-à-dire ne sont pas aromatiques.
À titre d'exemple, le white spirit contient 80 % d'hydrocarbures aliphatiques et 20 % d'hydrocarbures aromatiques[2].
Remarque : ce terme était à l'origine utilisé pour décrire les acides gras linéaires, notamment des acides aminés comme la glycine (G), l'alanine (A), la valine (V), la leucine (L), l'isoleucine (I) et la méthionine (M). Le seul acide aminé aliphatique cyclique d'importance est la proline (P).
Sous-catégorisation
On peut classer les composés aliphatiques selon leur état physique à température et pression ambiantes[2] :
- gaz : molécules contenant de 1 à 4 carbones (C1 à C4) : méthane, éthane, propane, butane ;
- liquide volatil : molécules contenant de 5 à 8 carbones (C5 à C8) : pentane, hexane, heptane, octane ;
- liquide peu volatil : molécules contenant de 9 à 16 carbones (C9 à C16) ;
- solide : supérieur à C16.
Au sein des composés aliphatiques, on peut distinguer[2] :
- les hydrocarbures saturés (alcanes, de formule chimique générale CnH2n+2 avec n = 1, 2…) ;
- les hydrocarbures insaturés, au sein desquels existent deux groupes :
- les alcènes (formule chimique : R–CH=CH–R', caractérisés par au moins une double liaison ; si la molécule comprend deux doubles liaisons, on parle de -diène (ex. : 1,3-butadiène) ; les alcènes les plus connus sont l'éthylène (C2), le propylène (C3) et le butylène (C4),
- les alcynes (formule chimique : R–C≡C–R'), à triple liaison. Ex. : acétylène (C2).
- Note : les alcanes sont moins toxiques (car moins réactifs) que les alcènes ou les alcynes qui ont des liaisons insaturées les rendant réactifs, y compris vis-à-vis d’eux-mêmes (ils se comportent alors comme des monomères ; propriété utilisée pour produire des polymères tels que le polyéthylène) ou vis à vis, ce qui est plus problématique pour le toxicologue, des molécules biologiques (ex. : le 1,3-Butadiène, issu des combustions d'hydrocarbures, est pour ces raisons cancérogène)[2].
on peut aussi distinguer :
- les aliphatiques à chaîne linéaire :
ex. : le n-hexane est le composé linéaire à six atomes de carbone (hexa- signifiant six) ; - les aliphatiques à chaîne ramifiée :
ex. : le méthylpentane est le composé ramifié à six atomes de carbone.
Des chiffres désignent le numéro de l’atome de carbone où se fait la « ramification ». Ainsi le 3-Méthylpentane a un radical méthyle (CH3) placé sur le troisième atome de carbone et le 2-Méthylpentane a un radical méthyle sur le second atome. Le 4-Méthylpentane n’existe pas ; il est identique au 2-Méthylpentane[2].
Propriétés
La plupart des composés aliphatiques sont de bons solvants et ils sont — plus ou moins facilement — inflammables (ce pourquoi ils sont utilisés comme carburants (du fioul au méthane en passant par le GPL ou l'acétylène utilisé par les soudeurs), après désoufrage pour retirer leur caractère acidifiant et corrosif).
Certains de leurs dérivés (ex. : hydrocarbures aliphatiques halogénés, solvants chlorés aliphatiques) peuvent être toxiques, écotoxiques, cancérigènes, mutagènes, ou sources de produits secondaires toxiques et écotoxiques quand ils brûlent (dioxines, furanes…) et chez certaines espèces neurotoxiques (ex. : chez des coquillages filtreurs comme la palourde[3]).
Exemples
Exemples de composés aliphatiques de faible poids moléculaire :
| Formule brute | Nom UICPA | Représentation | Classification chimique |
|---|---|---|---|
| CH4 | Méthane | 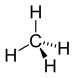
|
Alcane |
| C2H2 | Éthyne | Alcyne | |
| C2H4 | Éthène | 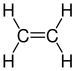
|
Alcène |
| C2H6 | Éthane | 
|
Alcane |
| C3H4 | Propyne | Alcyne | |
| C3H6 | Propène | 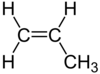
|
Alcène |
| C3H8 | Propane | 
|
Alcane |
| C4H6 | 1,2-Butadiène (en) | 
|
Diène |
| C4H6 | But-1-yne | 
|
Alcyne |
| C4H8 | But-1-ène | Alcène | |
| C4H10 | Butane | 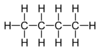
|
Alcane |
| C4H10 | 2-Méthylpropane | 
|
Alcane |
| C6H10 | Cyclohexène | Cycloalcène | |
| C5H12 | n-Pentane | Alcane | |
| C7H14 | Cycloheptane | Cycloalcane | |
| C7H14 | Méthylcyclohexane | 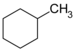
|
Cyclohexane |
| C8H8 | Cubane | 
|
Cyclobutane |
| C9H20 | Nonane | Alcane | |
| C10H12 | Dicyclopentadiène | 
|
Diène, Cycloalcène |
| C10H16 | Phellandrène | 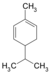 
|
Terpène, Diène, Cycloalcène |
| C10H16 | α-Terpinène | Terpène, Diène, Cycloalcène | |
| C10H16 | Limonène |  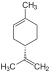
|
Terpène, Diène, Cycloalcène |
| C11H24 | Undécane | Alcane | |
| C30H50 | Squalène | Terpène, Polyène | |
| C2nH4n | Polyéthylène | Alcane |
Autres exemples :
Dérivés
Les hydrocarbures alicycliques sont des composés cycliques dérivés de la série aliphatique, avec par exemple[2] :
- les cycloalcanes (ex. : cyclohexane) ;
- les cycloalcènes (contenant une double liaison) ;
- les cycloalcadiènes (à deux doubles liaisons) ;
- les terpènes (très présents dans le monde végétal).
Références
- (en) G. P. Moss, P. A. S. Smith et D. Tavernier, Glossary of class names of organic compounds and reactive intermediates based on structure (IUPAC Recommendations 1995) [PDF], Aliphatic compounds, p. 7, Pure and Applied Chemistry, vol. 67, p. 1307-1375.
- Cicolella, A. (2008), Les composés organiques volatils (COV) : définition, classification et propriétés, Revue des Maladies Respiratoires, vol. 25, no 2, p. 155-163, DOI 10.1016/S0761-8425(08)71513-4.
- Spencer P.S., Kim M.S. et Sabri M.I. (2002), Aromatic as well as aliphatic hydrocarbon solvent axonopathy, International Journal of Hygiene and Environmental Health, 205, 131-136.
