« Composé aromatique » : différence entre les versions
reformulation introduction + paragraphe spécifique pour le benzène |
Aucun résumé des modifications |
||
| (36 versions intermédiaires par 29 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Voir homonymes|aromatique}} |
|||
Un '''composé aromatique''' est un [[composé organique]] qui contient un [[Composé cyclique|système cyclique]] respectant la [[règle de Hückel|règle d'aromaticité de Hückel]] : le système cyclique doit être plan et posséder (4''n'' + 2) [[électron]]s [[mésomérie|délocalisés]] dans un système cyclique, ''n'' étant le nombre de cycles constituant le système cyclique. Si le cycle contient un élément autre que du carbone, on parle d'[[hétérocycle]] aromatique. |
|||
[[Fichier:Benzène.png|vignette|Le benzène est la molécule aromatique la plus simple.]] |
|||
En [[chimie organique]], les '''composés aromatiques''' sont des [[Molécule|molécules]] telles que le [[benzène]] dont les atomes forment des [[Géométrie moléculaire|structures]] cycliques et planes particulièrement [[Stabilité moléculaire|stables]]. Le terme « aromatique », introduit par [[August Wilhelm von Hofmann]] en 1855, fait référence au fait que ces composés peuvent avoir une [[odeur]] forte contrairement aux [[Alcane|hydrocarbures saturés]] bien qu'on sache aujourd'hui qu'il n'existe pas de relation directe entre les propriétés [[Olfaction|olfactives]] et l'[[aromaticité]] chimique. Cette dernière est en effet définie pour un [[composé organique]] contenant un [[Composé cyclique|système cyclique]] par la [[règle de Hückel|règle d'aromaticité de Hückel]] : le système cyclique doit être plan et posséder (4''n'' + 2) [[électron]]s [[mésomérie|délocalisés]], ''n'' étant un entier naturel quelconque. Si le cycle contient des éléments autres que le carbone et l'hydrogène, on parle d'[[hétérocycle]] aromatique. |
|||
Les composés aromatiques libérés par les fleurs sont les substances les plus communes dans leur parfum<ref>{{Article|langue=en|auteur=F.P. Schiestl & S. Dötterl|titre=Feeding-induced rearrangement of green leaf volatiles reduces moth oviposition|périodique=Ecology LettersThe evolution of floral scent and insect chemical communication|date=mai 2010|volume=13|numéro=5|pages=643-656|doi=10.1111/j.1461-0248.2010.01451.x}}.</ref>. |
|||
== L'aromaticité du benzène == |
|||
== Aromaticité du benzène == |
|||
Le modèle des hydrocarbures aromatiques est le [[benzène]] {{fchim|C|6|H|6}}, constitué d'un cycle à 6 [[atome]]s de [[carbone]] formant un hexagone régulier et comportant six électrons délocalisés. La représentation de ce système est un hexagone dans lequel trois [[Liaison double|liaisons doubles]] alternent avec trois [[Liaison simple|liaisons simples]]. Les six liaisons sont de longueur identique, intermédiaire entre les longueurs de la simple et de la double liaison. |
Le modèle des hydrocarbures aromatiques est le [[benzène]] {{fchim|C|6|H|6}}, constitué d'un cycle à 6 [[atome]]s de [[carbone]] formant un hexagone régulier et comportant six électrons délocalisés. La représentation de ce système est un hexagone dans lequel trois [[Liaison double|liaisons doubles]] alternent avec trois [[Liaison simple|liaisons simples]]. Les six liaisons sont de longueur identique, intermédiaire entre les longueurs de la simple et de la double liaison. |
||
[[Fichier:Benzene mesomery.png|vignette| |
[[Fichier:Benzene mesomery.png|vignette|Les deux formes mésomères du benzène et la notation de la forme aromatique "moyenne"]] |
||
Le modèle développé par [[Friedrich Kekulé von Stradonitz|Kékulé]] pour le benzène consiste en deux formes mésomères, qui correspondent aux liaisons doubles et simples changeant de positions. Une autre représentation est celle de la liaison π au-dessus ou sous l'anneau. Ce modèle représente plus correctement la position de la densité d'électron dans l'anneau aromatique. |
Le modèle développé par [[Friedrich Kekulé von Stradonitz|Kékulé]] pour le benzène consiste en deux formes [[Mésomérie|mésomères]], qui correspondent aux liaisons doubles et simples changeant de positions. Une autre représentation est celle de la {{nobr|[[liaison π]]}} au-dessus ou sous l'anneau. Ce modèle représente plus correctement la position de la densité d'électron dans l'anneau aromatique. |
||
== |
== Typologie == |
||
=== Dérivés du benzène === |
|||
{{article connexe|Dérivé (chimie)}} |
|||
Les composés ci-dessous comportent un seul cycle aromatique à six atomes de carbone : |
|||
* le [[benzène]] ; |
|||
* les [[Hydrocarbure aromatique|hydrocarbures aromatiques]] monocycliques, parfois nommés [[alkylbenzène]]s : [[toluène]], [[xylène]]s, [[éthylbenzène]], [[cumène]], [[styrène]], [[mésitylène]]{{etc.}} ; |
|||
* le [[Phénol (molécule)|phénol]] et les [[Phénol (groupe)#Exemples de composés phénolés|composés phénolés]] ; |
|||
* l'[[aniline]] et les [[amine aromatique|amines aromatiques]] monocycliques, comme la [[p-phénylènediamine]] ; |
|||
* l'[[acide benzoïque]] ; |
|||
* le [[chlorobenzène]] ; |
|||
* le [[nitrobenzène]] ; |
|||
* l'[[acide salicylique]] et l'[[acide acétylsalicylique]] (aspirine) ; |
|||
* le [[paracétamol]] ; |
|||
* l'[[acide picrique]] ; |
|||
* le [[trinitrotoluène]] ; |
|||
* la [[phénacétine]]. |
|||
=== Hétérocycles aromatiques === |
|||
Un composé organique est dit '''aromatique''' quand il satisfait aux conditions suivantes : |
|||
Les [[hétérocycle]]s sont une classe de composés dans lesquels un ou plusieurs [[atome]]s de carbone d'un composé cyclique est remplacé par un élément dit hétérogène comme l'[[oxygène]], l'[[azote]], le [[phosphore]], le [[soufre]]{{etc.}} Les hétérocycles les plus courants contiennent un atome d'azote ou d'oxygène, par exemple : |
|||
# présence d'un cycle comportant un [[Liaison π|système π]] conjugué, formé de liaisons doubles et/ou de doublets non-liants ; |
|||
{{Début de colonnes|nombre=3}} |
|||
# chaque atome du cycle comporte une orbitale p ; |
|||
# les orbitales p se recouvrent (système π conjugué), la molécule étant plane au niveau de ce composé cyclique ; |
|||
# la délocalisation des électrons π entraîne une diminution de l'énergie de la molécule. |
|||
Si les trois premiers critères sont satisfaits, mais que la délocalisation entraînerait une augmentation de l'énergie, le composé est dit [[anti-aromaticité|anti-aromatique]]. |
|||
En pratique, le {{4e}} critère est traduit par la [[règle de Hückel]] : la délocalisation entraîne une diminution de l'énergie de la molécule (et donc, une stabilisation de cette dernière) si le nombre d'électrons π est égal à (4''n''+2), où ''n'' est un entier positif ou nul. À l'inverse, les composés [[Anti-aromaticité|anti-aromatiques]] (lorsque la délocalisation des électrons entraîne une augmentation de l'énergie, et donc une perte de stabilité) possèdent 4''n'' électrons π. Cette règle est valable pour les composés relativement simples, possédant au plus quelques cycles, au-delà, il faut avoir recours à d'autres méthodes, semi-empiriques ou faisant appel à la mécanique quantique. |
|||
En présence d'un composé cyclique avec des liaisons π conjuguées dont la délocalisation des électrons π entraîne une énergie similaire, on est en présence d'un ''composé non-aromatique'', soit [[composé aliphatique|aliphatique]]. |
|||
Les [[fullerène]]s comme le {{fchim|C|60}} ont des propriétés aromatiques, bien qu'ils ne soient pas globalement plans. |
|||
== Énergie de stabilisation == |
|||
{|class="wikitable" width="100%" |
|||
!style="text-align: left"|Nom |
|||
!style="text-align: left"|Formule brute |
|||
!style="text-align: left"|Énergie de stabilisation ({{unité||kJ||mol|-1}}) |
|||
|- |
|||
|[[Benzène]] |
|||
|{{fchim|C|6|H|6}} |
|||
|37,9 |
|||
|- |
|||
|[[Furane]] |
|||
|{{fchim|C|4|H|4|O}} |
|||
|16 |
|||
|- |
|||
|[[Pyrrole]] |
|||
|{{fchim|C|4|H|5|N}} |
|||
|16 |
|||
|- |
|||
|[[Thiophène]] |
|||
|{{fchim|C|4|H|4|S}} |
|||
|17 |
|||
|- |
|||
|[[Pyridine]] |
|||
|{{fchim|C|5|H|5|N}} |
|||
|2,26 |
|||
|- |
|||
|[[Naphtalène]] |
|||
|{{fchim|C|10|H|8}} |
|||
|71 |
|||
|- |
|||
|[[Indole]] |
|||
|{{fchim||C|8|H|7|N}} |
|||
|48 |
|||
|- |
|||
|[[Quinoléine]] |
|||
|{{fchim|C|9|H|7|N}} |
|||
|55 |
|||
|- |
|||
|[[Anthracène]] |
|||
|{{fchim|C|14|H|10}} |
|||
|104 |
|||
|- |
|||
|[[Carbazole]] |
|||
|{{fchim|C|12|H|9|N}} |
|||
|83 |
|||
|- |
|||
|[[Acridine]] |
|||
|{{fchim|C|13|H|9|N}} |
|||
|107 |
|||
|} |
|||
== Familles d'aromatiques == |
|||
=== Les dérivés du benzène === |
|||
Les composés ci-dessous comportent une seul cycle aromatique à six atomes de carbone : |
|||
* le [[benzène]] |
|||
* les [[Hydrocarbure aromatique|hydrocarbures aromatiques]] monocycliques, parfois nommés alkylbenzènes : [[toluène]], [[xylène]]s, [[éthylbenzène]], [[cumène]], [[styrène]], [[mésitylène]]... |
|||
* le [[Phénol (molécule)|phénol]] et les [[Phénol (groupe)#Composés phénolés|composés phénolés]] |
|||
* l'[[aniline]] et les [[amine aromatique|amines aromatiques]] monocycliques, comme la [[p-phénylènediamine]] |
|||
* l'[[acide benzoïque]] |
|||
* le [[chlorobenzène]] |
|||
* le [[nitrobenzène]] |
|||
* l'[[acide salicylique]] et l'[[acide acétylsalicylique]] (aspirine) |
|||
* le [[paracétamol]] |
|||
* l'[[acide picrique]] |
|||
* le [[trinitrotoluène]] |
|||
* la [[phénacétine]] |
|||
=== Les hétérocycles aromatiques === |
|||
Les [[hétérocycle]]s sont une classe de composés dans lesquels un ou plusieurs [[atome]](s) de carbone d'un composé cyclique est remplacé par un élément dit hétérogène comme l'[[oxygène]], l'[[azote]], le [[phosphore]], le [[soufre]]{{etc.}} Les hétérocycles les plus courants contiennent un atome d'azote ou d'oxygène, comme par exemple : |
|||
* la [[pyridine]] |
* la [[pyridine]] |
||
* le [[furane]] |
* le [[furane]] |
||
| Ligne 104 : | Ligne 42 : | ||
* la [[quinoléine]] |
* la [[quinoléine]] |
||
* l'[[isoquinoléine]] |
* l'[[isoquinoléine]] |
||
{{Fin de colonnes}} |
|||
Les petits systèmes hétérocycliques aromatiques sont le [[borirène]] et la forme cationique de l'[[aziridine]]. |
|||
=== |
=== Aromatiques polycycliques === |
||
{{Article détaillé|Hydrocarbure aromatique polycyclique}} |
{{Article détaillé|Hydrocarbure aromatique polycyclique}} |
||
* Le [[naphtalène]] {{fchim|C|10|H|8}} ({{ |
* Le [[naphtalène]] {{fchim|C|10|H|8}} ({{nobr|2 cycles}} accolés) |
||
* L'[[anthracène]] {{fchim|C|14|H|10}} ({{ |
* L'[[anthracène]] {{fchim|C|14|H|10}} ({{nobr|3 cycles}} accolés) |
||
Quelques arènes importants sont appelés |
Quelques arènes importants sont appelés HAP, hydrocarbure aromatique polycyclique (PAH en anglais). Ils sont composés de 4 à {{nobr|7 cycles}}. Un HAP connu est le [[benzopyrène]] qui est très [[cancérogène]]. |
||
Les HAP forment une vaste famille de composés aux propriétés similaires. |
Les HAP forment une vaste famille de composés aux propriétés similaires. |
||
Les HAP existent à l'état naturel dans le pétrole brut : on les appelle les hydrocarbures pétrogéniques. |
Les HAP existent à l'état naturel dans le pétrole brut : on les appelle les hydrocarbures pétrogéniques. |
||
Ils se caractérisent par une forte proportion d'hydrocarbures aromatiques ramifiés, c'est-à-dire |
Ils se caractérisent par une forte proportion d'hydrocarbures aromatiques ramifiés, c'est-à-dire substitués par des [[alkyle|groupes alkyle]]. |
||
La pyrolyse et la combustion incomplète de matières organiques, comme |
La pyrolyse et la combustion incomplète de matières organiques, comme l'incinération des déchets, la combustion du bois, du charbon, le fonctionnement des [[moteur à essence|moteurs à essence]] ou des [[moteur Diesel|moteurs Diesel]] produisent aussi des HAP : on les appelle les hydrocarbures pyrogéniques. |
||
La combustion des cigarettes produit des HAP et contribue à la présence d'HAPs dans les bâtiments. |
La combustion des cigarettes produit des HAP et contribue à la présence d'HAPs dans les bâtiments. |
||
Ces HAP, liés à l'activité humaine, sont peu ramifiés et ce sont surtout ceux-là qui sont présents dans notre environnement, généralement sous forme de mélanges plus ou moins complexes. |
Ces HAP, liés à l'activité humaine, sont peu ramifiés et ce sont surtout ceux-là qui sont présents dans notre environnement, généralement sous forme de mélanges plus ou moins complexes. |
||
La présence de HAP dans l'environnement est préoccupante, essentiellement à cause de leurs propriétés cancérigènes. |
La présence de HAP dans l'environnement est préoccupante, essentiellement à cause de leurs propriétés cancérigènes. |
||
C'est |
C'est tout particulièrement le cas du [[benzopyrène]], du [[Benzanthracène|benzoanthracène]], du [[benzofluoranthène]], de l'[[indéno pyrène]] et du [[benzopérylène]]. |
||
La plupart des HAP sont assez résistants à la biodégradation. Cette dégradation se fait dans les couches superficielles du sol, grâce notamment à l'action de certaines [[bactérie]]s. |
La plupart des HAP sont assez résistants à la biodégradation. Cette dégradation se fait dans les couches superficielles du sol, grâce notamment à l'action de certaines [[bactérie]]s. |
||
| Ligne 127 : | Ligne 67 : | ||
Les hydrocarbures aromatiques polycycliques pourraient être présents dans les [[milieu interstellaire|poussières interstellaires]]. |
Les hydrocarbures aromatiques polycycliques pourraient être présents dans les [[milieu interstellaire|poussières interstellaires]]. |
||
Ces molécules sont très résistantes aux conditions hostiles existant dans le milieu interstellaire et présentent des [[spectroscopie|spectres]] en accord avec les raies observées dans les poussières interstellaires, notamment aux longueurs d'onde de 6,2 / 7,7 / 8,3 / 11,3 et {{ |
Ces molécules sont très résistantes aux conditions hostiles existant dans le milieu interstellaire et présentent des [[spectroscopie|spectres]] en accord avec les raies observées dans les poussières interstellaires, notamment aux longueurs d'onde de 6,2 / 7,7 / 8,3 / 11,3 et {{unité|12.8|[[micromètre|µm]]}}. |
||
Formées d'une vingtaine à quelques centaines d'atomes, ces molécules sont nettement plus grandes que les autres molécules détectées dans le milieu interstellaire. |
Formées d'une vingtaine à quelques centaines d'atomes, ces molécules sont nettement plus grandes que les autres molécules détectées dans le milieu interstellaire. |
||
En 1994, Moreels proposa la présence de [[phénanthrène]] dans la [[comète de Halley]] pour expliquer la raie à {{ |
En 1994, Moreels proposa la présence de [[phénanthrène]] dans la [[comète de Halley]] pour expliquer la raie à {{unité/2|3.28|µm}}, raie aussi observée dans plusieurs autres [[comète]]s<ref>Bockelée-Morvan {{et al.}}, 1995.</ref>. |
||
Les HAP pourraient survivre à l'explosion d'une supernova, soit à environ {{nombre|8|millions}} de [[Degré Celsius|degrés Celsius]]<ref>D'après Achim Tappe (Centre d'Astophysique de Harvard).</ref>. |
|||
== |
== Références == |
||
{{Références |
{{Références}} |
||
== Articles connexes == |
== Articles connexes == |
||
* [[Noyau aromatique simple]] |
|||
* [[Anti-aromaticité]] |
* [[Anti-aromaticité]] |
||
| Ligne 143 : | Ligne 82 : | ||
{{portail|chimie}} |
{{portail|chimie}} |
||
{{DEFAULTSORT:Compose aromatique}} |
|||
[[Catégorie:Composé aromatique|*]] |
[[Catégorie:Composé aromatique|*]] |
||
[[Catégorie:Chimie organique physique]] |
[[Catégorie:Chimie organique physique]] |
||
Dernière version du 11 juillet 2023 à 03:56
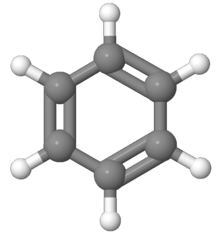
En chimie organique, les composés aromatiques sont des molécules telles que le benzène dont les atomes forment des structures cycliques et planes particulièrement stables. Le terme « aromatique », introduit par August Wilhelm von Hofmann en 1855, fait référence au fait que ces composés peuvent avoir une odeur forte contrairement aux hydrocarbures saturés bien qu'on sache aujourd'hui qu'il n'existe pas de relation directe entre les propriétés olfactives et l'aromaticité chimique. Cette dernière est en effet définie pour un composé organique contenant un système cyclique par la règle d'aromaticité de Hückel : le système cyclique doit être plan et posséder (4n + 2) électrons délocalisés, n étant un entier naturel quelconque. Si le cycle contient des éléments autres que le carbone et l'hydrogène, on parle d'hétérocycle aromatique.
Les composés aromatiques libérés par les fleurs sont les substances les plus communes dans leur parfum[1].
Aromaticité du benzène[modifier | modifier le code]
Le modèle des hydrocarbures aromatiques est le benzène C6H6, constitué d'un cycle à 6 atomes de carbone formant un hexagone régulier et comportant six électrons délocalisés. La représentation de ce système est un hexagone dans lequel trois liaisons doubles alternent avec trois liaisons simples. Les six liaisons sont de longueur identique, intermédiaire entre les longueurs de la simple et de la double liaison.

Le modèle développé par Kékulé pour le benzène consiste en deux formes mésomères, qui correspondent aux liaisons doubles et simples changeant de positions. Une autre représentation est celle de la liaison π au-dessus ou sous l'anneau. Ce modèle représente plus correctement la position de la densité d'électron dans l'anneau aromatique.
Typologie[modifier | modifier le code]
Dérivés du benzène[modifier | modifier le code]
Les composés ci-dessous comportent un seul cycle aromatique à six atomes de carbone :
- le benzène ;
- les hydrocarbures aromatiques monocycliques, parfois nommés alkylbenzènes : toluène, xylènes, éthylbenzène, cumène, styrène, mésitylène, etc. ;
- le phénol et les composés phénolés ;
- l'aniline et les amines aromatiques monocycliques, comme la p-phénylènediamine ;
- l'acide benzoïque ;
- le chlorobenzène ;
- le nitrobenzène ;
- l'acide salicylique et l'acide acétylsalicylique (aspirine) ;
- le paracétamol ;
- l'acide picrique ;
- le trinitrotoluène ;
- la phénacétine.
Hétérocycles aromatiques[modifier | modifier le code]
Les hétérocycles sont une classe de composés dans lesquels un ou plusieurs atomes de carbone d'un composé cyclique est remplacé par un élément dit hétérogène comme l'oxygène, l'azote, le phosphore, le soufre, etc. Les hétérocycles les plus courants contiennent un atome d'azote ou d'oxygène, par exemple :
- la pyridine
- le furane
- le thiophène
- le pyrrole
- la porphyrine
- la chlorine
- l'indole
- le benzofurane
- la quinoléine
- l'isoquinoléine
Les petits systèmes hétérocycliques aromatiques sont le borirène et la forme cationique de l'aziridine.
Aromatiques polycycliques[modifier | modifier le code]
- Le naphtalène C10H8 (2 cycles accolés)
- L'anthracène C14H10 (3 cycles accolés)
Quelques arènes importants sont appelés HAP, hydrocarbure aromatique polycyclique (PAH en anglais). Ils sont composés de 4 à 7 cycles. Un HAP connu est le benzopyrène qui est très cancérogène. Les HAP forment une vaste famille de composés aux propriétés similaires.
Les HAP existent à l'état naturel dans le pétrole brut : on les appelle les hydrocarbures pétrogéniques. Ils se caractérisent par une forte proportion d'hydrocarbures aromatiques ramifiés, c'est-à-dire substitués par des groupes alkyle. La pyrolyse et la combustion incomplète de matières organiques, comme l'incinération des déchets, la combustion du bois, du charbon, le fonctionnement des moteurs à essence ou des moteurs Diesel produisent aussi des HAP : on les appelle les hydrocarbures pyrogéniques. La combustion des cigarettes produit des HAP et contribue à la présence d'HAPs dans les bâtiments. Ces HAP, liés à l'activité humaine, sont peu ramifiés et ce sont surtout ceux-là qui sont présents dans notre environnement, généralement sous forme de mélanges plus ou moins complexes.
La présence de HAP dans l'environnement est préoccupante, essentiellement à cause de leurs propriétés cancérigènes. C'est tout particulièrement le cas du benzopyrène, du benzoanthracène, du benzofluoranthène, de l'indéno pyrène et du benzopérylène.
La plupart des HAP sont assez résistants à la biodégradation. Cette dégradation se fait dans les couches superficielles du sol, grâce notamment à l'action de certaines bactéries. La majorité des HAP présents dans les eaux de surface ont une origine atmosphérique et, pour la plupart, sont adsorbés sur les sédiments.
Les hydrocarbures aromatiques polycycliques pourraient être présents dans les poussières interstellaires. Ces molécules sont très résistantes aux conditions hostiles existant dans le milieu interstellaire et présentent des spectres en accord avec les raies observées dans les poussières interstellaires, notamment aux longueurs d'onde de 6,2 / 7,7 / 8,3 / 11,3 et 12,8 µm. Formées d'une vingtaine à quelques centaines d'atomes, ces molécules sont nettement plus grandes que les autres molécules détectées dans le milieu interstellaire.
En 1994, Moreels proposa la présence de phénanthrène dans la comète de Halley pour expliquer la raie à 3,28 μm, raie aussi observée dans plusieurs autres comètes[2].
Références[modifier | modifier le code]
- (en) F.P. Schiestl & S. Dötterl, « Feeding-induced rearrangement of green leaf volatiles reduces moth oviposition », Ecology LettersThe evolution of floral scent and insect chemical communication, vol. 13, no 5, , p. 643-656 (DOI 10.1111/j.1461-0248.2010.01451.x).
- Bockelée-Morvan et al., 1995.
