« Composé aromatique » : différence entre les versions
m Esprit Fugace a déplacé la page Aromaticité vers Composé aromatique par-dessus une redirection : L'article parle bien des composés aromatique, pas de la mesure de l'aromaticité |
Aucun résumé des modifications |
||
| (44 versions intermédiaires par 34 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
{{Voir homonymes|aromatique}} |
|||
En chimie organique, un '''composé aromatique''' est un composé chimique qui contient un système cyclique respectant la [[règle de Hückel|règle d'aromaticité de Hückel]]. Un exemple classique est celui des cycles du type du [[benzène]], avec 6 atomes de [[carbone]] formant un hexagone régulier et six [[électron]]s délocalisés tout autour du cycle. La représentation de ce système est un cycle hexagonal avec trois [[Liaison double|doubles liaisons]] alternées avec trois liaisons simples. Les six liaisons sont d'une longueur identique et sont situées entre la simple et la double liaison. |
|||
[[Fichier:Benzène.png|vignette|Le benzène est la molécule aromatique la plus simple.]] |
|||
En [[chimie organique]], les '''composés aromatiques''' sont des [[Molécule|molécules]] telles que le [[benzène]] dont les atomes forment des [[Géométrie moléculaire|structures]] cycliques et planes particulièrement [[Stabilité moléculaire|stables]]. Le terme « aromatique », introduit par [[August Wilhelm von Hofmann]] en 1855, fait référence au fait que ces composés peuvent avoir une [[odeur]] forte contrairement aux [[Alcane|hydrocarbures saturés]] bien qu'on sache aujourd'hui qu'il n'existe pas de relation directe entre les propriétés [[Olfaction|olfactives]] et l'[[aromaticité]] chimique. Cette dernière est en effet définie pour un [[composé organique]] contenant un [[Composé cyclique|système cyclique]] par la [[règle de Hückel|règle d'aromaticité de Hückel]] : le système cyclique doit être plan et posséder (4''n'' + 2) [[électron]]s [[mésomérie|délocalisés]], ''n'' étant un entier naturel quelconque. Si le cycle contient des éléments autres que le carbone et l'hydrogène, on parle d'[[hétérocycle]] aromatique. |
|||
Les composés aromatiques libérés par les fleurs sont les substances les plus communes dans leur parfum<ref>{{Article|langue=en|auteur=F.P. Schiestl & S. Dötterl|titre=Feeding-induced rearrangement of green leaf volatiles reduces moth oviposition|périodique=Ecology LettersThe evolution of floral scent and insect chemical communication|date=mai 2010|volume=13|numéro=5|pages=643-656|doi=10.1111/j.1461-0248.2010.01451.x}}.</ref>. |
|||
Ce modèle a été développé par [[Friedrich Kekulé von Stradonitz]] pour le [[benzène]] et consiste en deux formes en résonance, lesquelles correspondent aux liaisons doubles et simples changeant de positions. Une autre représentation est celle de la liaison π au-dessus ou sous l'anneau. Ce modèle représente plus correctement la position de la densité d'électron dans l'anneau aromatique. |
|||
== Aromaticité du benzène == |
|||
Si le cycle contient un élément autre que du carbone, on parle d'[[hétérocycle]] aromatique. Les hydrocarbures possédant au moins 10 atomes de [[carbone]] ont pour propriété un haut [[indice d'octane]]. |
|||
Le modèle des hydrocarbures aromatiques est le [[benzène]] {{fchim|C|6|H|6}}, constitué d'un cycle à 6 [[atome]]s de [[carbone]] formant un hexagone régulier et comportant six électrons délocalisés. La représentation de ce système est un hexagone dans lequel trois [[Liaison double|liaisons doubles]] alternent avec trois [[Liaison simple|liaisons simples]]. Les six liaisons sont de longueur identique, intermédiaire entre les longueurs de la simple et de la double liaison. |
|||
En tant que [[composé insaturé|composés '''insaturés''']] (présence de doubles liaisons), ils se prêtent facilement à des transformations diverses (par [[réaction chimique|réactions chimiques]] interposées) donnant naissance à des espèces chimiques nouvelles, surtout dans le domaine des [[matière plastique|matières plastiques]]. |
|||
[[Fichier:Benzene mesomery.png|vignette|Les deux formes mésomères du benzène et la notation de la forme aromatique "moyenne"]] |
|||
== Définition théorique == |
|||
Le modèle développé par [[Friedrich Kekulé von Stradonitz|Kékulé]] pour le benzène consiste en deux formes [[Mésomérie|mésomères]], qui correspondent aux liaisons doubles et simples changeant de positions. Une autre représentation est celle de la {{nobr|[[liaison π]]}} au-dessus ou sous l'anneau. Ce modèle représente plus correctement la position de la densité d'électron dans l'anneau aromatique. |
|||
== Typologie == |
|||
Un [[composé organique]] est dit '''aromatique''' quand il satisfait aux conditions suivantes : |
|||
=== Dérivés du benzène === |
|||
# présence d'un cycle comportant un [[Liaison π|système π]] conjugué, formé de liaisons doubles et/ou de doublets non-liants ; |
|||
{{article connexe|Dérivé (chimie)}} |
|||
# chaque atome du cycle comporte une orbitale p ; |
|||
Les composés ci-dessous comportent un seul cycle aromatique à six atomes de carbone : |
|||
# les orbitales p se recouvrent (système π conjugué), la molécule étant plane au niveau de ce composé cyclique ; |
|||
* le [[benzène]] ; |
|||
# la délocalisation des électrons π entraîne une diminution de l'énergie de la molécule. |
|||
* les [[Hydrocarbure aromatique|hydrocarbures aromatiques]] monocycliques, parfois nommés [[alkylbenzène]]s : [[toluène]], [[xylène]]s, [[éthylbenzène]], [[cumène]], [[styrène]], [[mésitylène]]{{etc.}} ; |
|||
* le [[Phénol (molécule)|phénol]] et les [[Phénol (groupe)#Exemples de composés phénolés|composés phénolés]] ; |
|||
* l'[[aniline]] et les [[amine aromatique|amines aromatiques]] monocycliques, comme la [[p-phénylènediamine]] ; |
|||
* l'[[acide benzoïque]] ; |
|||
* le [[chlorobenzène]] ; |
|||
* le [[nitrobenzène]] ; |
|||
* l'[[acide salicylique]] et l'[[acide acétylsalicylique]] (aspirine) ; |
|||
* le [[paracétamol]] ; |
|||
* l'[[acide picrique]] ; |
|||
* le [[trinitrotoluène]] ; |
|||
* la [[phénacétine]]. |
|||
=== Hétérocycles aromatiques === |
|||
Si les trois premiers critères sont satisfaits, mais que la délocalisation entraînerait une augmentation de l'énergie, le composé est dit [[anti-aromaticité|anti-aromatique]]. |
|||
Les [[hétérocycle]]s sont une classe de composés dans lesquels un ou plusieurs [[atome]]s de carbone d'un composé cyclique est remplacé par un élément dit hétérogène comme l'[[oxygène]], l'[[azote]], le [[phosphore]], le [[soufre]]{{etc.}} Les hétérocycles les plus courants contiennent un atome d'azote ou d'oxygène, par exemple : |
|||
{{Début de colonnes|nombre=3}} |
|||
* la [[pyridine]] |
|||
* le [[furane]] |
|||
* le [[thiophène]] |
|||
* le [[pyrrole]] |
|||
* la [[porphyrine]] |
|||
* la [[chlorine]] |
|||
* l'[[indole]] |
|||
* le [[benzofurane]] |
|||
* la [[quinoléine]] |
|||
* l'[[isoquinoléine]] |
|||
{{Fin de colonnes}} |
|||
Les petits systèmes hétérocycliques aromatiques sont le [[borirène]] et la forme cationique de l'[[aziridine]]. |
|||
=== Aromatiques polycycliques === |
|||
En pratique, le 4{{e}} critère est traduit par la [[règle de Hückel]] : la délocalisation entraîne une diminution de l'énergie de la molécule (et donc, une stabilisation de cette dernière) si le nombre d'électrons π est égal à ''4n+2'', où n est un entier positif ou nul. À l'inverse, les composés antiaromatiques (lorsque la délocalisation des électrons entraîne une augmentation de l'énergie, et donc une perte de stabilité) possèdent ''4n'' électrons π. Cette règle est valable pour les composés relativement simples, possédant au plus quelques cycles, au-delà, il faut avoir recours à d'autres méthodes, semi-empiriques ou faisant appel à la mécanique quantique. |
|||
En présence d'un composé cyclique avec des liaisons π conjuguées dont la délocalisation des électrons π entraîne une énergie similaire, on est en présence d'un ''composé non-aromatique'', soit [[composé aliphatique|aliphatique]]. |
|||
Le plus simple des hydrocarbures aromatiques est le [[benzène]] C<sub>6</sub>H<sub>6</sub>. Les [[fullerène]]s comme le C<sub>60</sub> ont également des propriétés aromatiques, bien qu'ils ne soient pas globalement plans. |
|||
== Énergie de stabilisation == |
|||
{|class="wikitable" width="100%" |
|||
!style="text-align: left"|Nom |
|||
!style="text-align: left"|Formule brute |
|||
!style="text-align: left"|Énergie de stabilisation ({{unité||kJ||mol|-1}}) |
|||
|- |
|||
|[[Benzène]] |
|||
|C<sub>6</sub>H<sub>6</sub> |
|||
|37,9 |
|||
|- |
|||
|[[Furane]] |
|||
|C<sub>4</sub>H<sub>4</sub>O |
|||
|16 |
|||
|- |
|||
|[[Pyrrole]] |
|||
|C<sub>4</sub>H<sub>5</sub>N |
|||
|16 |
|||
|- |
|||
|[[Thiophène]] |
|||
|C<sub>4</sub>H<sub>4</sub>S |
|||
|17 |
|||
|- |
|||
|[[Pyridine]] |
|||
|C<sub>5</sub>H<sub>5</sub>N |
|||
|2,26 |
|||
|- |
|||
|[[Naphtalène]] |
|||
|C<sub>10</sub>H<sub>8</sub> |
|||
|71 |
|||
|- |
|||
|[[Indole]] |
|||
|C<sub>8</sub>H<sub>7</sub>N |
|||
|48 |
|||
|- |
|||
|[[Quinoléine]] |
|||
|C<sub>9</sub>H<sub>7</sub>N |
|||
|55 |
|||
|- |
|||
|[[Anthracène]] |
|||
|C<sub>14</sub>H<sub>10</sub> |
|||
|104 |
|||
|- |
|||
|[[Carbazole]] |
|||
|C<sub>12</sub>H<sub>9</sub>N |
|||
|83 |
|||
|- |
|||
|[[Acridine]] |
|||
|C<sub>13</sub>H<sub>9</sub>N |
|||
|107 |
|||
|} |
|||
== Familles d'aromatiques == |
|||
=== Les composés du benzène === |
|||
{{Article détaillé|Arène (chimie)}} |
|||
* Le [[benzène]] et ses dérivés |
|||
** Les [[Phénol (groupe)|phénols]] |
|||
** L'[[aniline]] |
|||
** Le [[phénanthrène]] |
|||
** Le [[benzofurane]] |
|||
** La [[quinoléine]] |
|||
** L'[[isoquinoléine]] |
|||
** Les [[amine aromatique|amines aromatiques]] |
|||
* Les [[benzoïde]]s (benzènes polycycliques) |
|||
Un exemple très utilisé d'alkylbenzène est le [[toluène]] [C<sub>6</sub>H<sub>5</sub>-CH<sub>3</sub>]. |
|||
=== Les hétérocycles aromatiques === |
|||
Les [[hétérocycle]]s sont une classe de composés dans lesquels un ou plusieurs [[atome]](s) de carbone d'un composé cyclique est remplacé par un élément dit hétérogène comme l'[[oxygène]], l'[[azote]], le [[phosphore]], le [[soufre]], etc. Les hétérocycles les plus courants contiennent un atome d'azote ou d'oxygène. Voici quelques exemples d'[[Hétérocycle#Exemples|hétérocycles aromatiques]]: |
|||
* La [[pyridine]] |
|||
* Le [[furane]] |
|||
* Le [[thiophène]] |
|||
* Le [[pyrrole]] |
|||
* La [[porphyrine]] |
|||
* La [[chlorine]] |
|||
* L'[[indole]] |
|||
=== Les aromatiques polycycliques === |
|||
{{Article détaillé|Hydrocarbure aromatique polycyclique}} |
{{Article détaillé|Hydrocarbure aromatique polycyclique}} |
||
* Le [[naphtalène]] C |
* Le [[naphtalène]] {{fchim|C|10|H|8}} ({{nobr|2 cycles}} accolés) |
||
* L'[[anthracène]] C |
* L'[[anthracène]] {{fchim|C|14|H|10}} ({{nobr|3 cycles}} accolés) |
||
Quelques arènes importants sont appelés |
Quelques arènes importants sont appelés HAP, hydrocarbure aromatique polycyclique (PAH en anglais). Ils sont composés de 4 à {{nobr|7 cycles}}. Un HAP connu est le [[benzopyrène]] qui est très [[cancérogène]]. |
||
Les HAP forment une vaste famille de composés aux propriétés similaires. |
Les HAP forment une vaste famille de composés aux propriétés similaires. |
||
Les |
Les HAP existent à l'état naturel dans le pétrole brut : on les appelle les hydrocarbures pétrogéniques. |
||
Ils se caractérisent par une forte proportion d'hydrocarbures aromatiques ramifiés, c'est-à-dire |
Ils se caractérisent par une forte proportion d'hydrocarbures aromatiques ramifiés, c'est-à-dire substitués par des [[alkyle|groupes alkyle]]. |
||
La pyrolyse et la combustion incomplète de matières organiques, comme |
La pyrolyse et la combustion incomplète de matières organiques, comme l'incinération des déchets, la combustion du bois, du charbon, le fonctionnement des [[moteur à essence|moteurs à essence]] ou des [[moteur Diesel|moteurs Diesel]] produisent aussi des HAP : on les appelle les hydrocarbures pyrogéniques. |
||
La combustion des cigarettes produit des |
La combustion des cigarettes produit des HAP et contribue à la présence d'HAPs dans les bâtiments. |
||
Ces |
Ces HAP, liés à l'activité humaine, sont peu ramifiés et ce sont surtout ceux-là qui sont présents dans notre environnement, généralement sous forme de mélanges plus ou moins complexes. |
||
La présence de |
La présence de HAP dans l'environnement est préoccupante, essentiellement à cause de leurs propriétés cancérigènes. |
||
C'est |
C'est tout particulièrement le cas du [[benzopyrène]], du [[Benzanthracène|benzoanthracène]], du [[benzofluoranthène]], de l'[[indéno pyrène]] et du [[benzopérylène]]. |
||
La plupart des |
La plupart des HAP sont assez résistants à la biodégradation. Cette dégradation se fait dans les couches superficielles du sol, grâce notamment à l'action de certaines [[bactérie]]s. |
||
La majorité des |
La majorité des HAP présents dans les eaux de surface ont une origine atmosphérique et, pour la plupart, sont adsorbés sur les sédiments. |
||
Les hydrocarbures aromatiques polycycliques pourraient être présents dans les [[milieu interstellaire|poussières interstellaires]]. |
Les hydrocarbures aromatiques polycycliques pourraient être présents dans les [[milieu interstellaire|poussières interstellaires]]. |
||
Ces molécules sont très résistantes aux conditions hostiles existant dans le milieu interstellaire et présentent des [[spectroscopie|spectres]] en accord avec les raies observées dans les poussières interstellaires, notamment aux longueurs d'onde de 6,2 / 7,7 / 8,3 / 11,3 et 12 |
Ces molécules sont très résistantes aux conditions hostiles existant dans le milieu interstellaire et présentent des [[spectroscopie|spectres]] en accord avec les raies observées dans les poussières interstellaires, notamment aux longueurs d'onde de 6,2 / 7,7 / 8,3 / 11,3 et {{unité|12.8|[[micromètre|µm]]}}. |
||
Formées d'une vingtaine à quelques centaines d'atomes, ces molécules sont nettement plus grandes que les autres molécules détectées dans le milieu interstellaire. |
Formées d'une vingtaine à quelques centaines d'atomes, ces molécules sont nettement plus grandes que les autres molécules détectées dans le milieu interstellaire. |
||
En 1994, Moreels proposa la présence de [[phénanthrène]] dans la [[comète de Halley]] pour expliquer la raie à 3 |
En 1994, Moreels proposa la présence de [[phénanthrène]] dans la [[comète de Halley]] pour expliquer la raie à {{unité/2|3.28|µm}}, raie aussi observée dans plusieurs autres [[comète]]s<ref>Bockelée-Morvan {{et al.}}, 1995.</ref>. |
||
== Références == |
|||
Les HAPs pourraient survivre à l'explosion d'une supernova, soit à environ 8 millions de [[degrés Celsius]]<ref>D'après Achim Tappe (Centre d'Astophysique de Harvard)</ref>. |
|||
{{Références}} |
|||
== Notes == |
|||
{{Références|colonnes = 1}} |
|||
== Articles connexes == |
== Articles connexes == |
||
* [[Noyau aromatique simple]] |
|||
* [[Anti-aromaticité]] |
* [[Anti-aromaticité]] |
||
{{Palette |
{{Palette|Liaisons chimiques}} |
||
{{portail|chimie}} |
|||
{{portail chimie}} |
|||
[[Catégorie:Composé aromatique|*]] |
[[Catégorie:Composé aromatique|*]] |
||
[[Catégorie:Chimie organique physique]] |
[[Catégorie:Chimie organique physique]] |
||
[[ar:عطرية]] |
|||
[[cs:Aromaticita]] |
|||
[[da:Aromatisk forbindelse]] |
|||
[[de:Aromaten]] |
|||
[[el:Αρωματικός χαρακτήρας]] |
|||
[[en:Aromaticity]] |
|||
[[eo:Aromatoj]] |
|||
[[es:Aromaticidad]] |
|||
[[et:Aromaatsed ühendid]] |
|||
[[fa:پیوند آروماتیک]] |
|||
[[fi:Aromaattinen yhdiste]] |
|||
[[ga:Aramatacht]] |
|||
[[hr:Aromatski spojevi]] |
|||
[[hu:Aromás vegyületek]] |
|||
[[id:Aromatik]] |
|||
[[ja:芳香族化合物]] |
|||
[[ko:방향성]] |
|||
[[lt:Aromatiniai junginiai]] |
|||
[[mk:Ароматично соединение]] |
|||
[[nl:Aromaticiteit]] |
|||
[[no:Aromater]] |
|||
[[pl:Aromatyczność]] |
|||
[[pt:Aromaticidade]] |
|||
[[ru:Ароматичность]] |
|||
[[sh:Aromatičnost]] |
|||
[[simple:Aromatic hydrocarbon]] |
|||
[[sl:Aromatičnost]] |
|||
[[sr:Aromatičnost]] |
|||
[[sv:Aromaticitet]] |
|||
[[tr:Aromatiklik]] |
|||
[[uk:Ароматичність]] |
|||
[[zh:芳香性]] |
|||
Dernière version du 11 juillet 2023 à 03:56
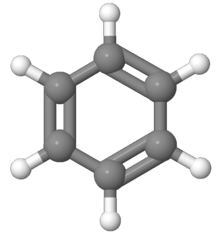
En chimie organique, les composés aromatiques sont des molécules telles que le benzène dont les atomes forment des structures cycliques et planes particulièrement stables. Le terme « aromatique », introduit par August Wilhelm von Hofmann en 1855, fait référence au fait que ces composés peuvent avoir une odeur forte contrairement aux hydrocarbures saturés bien qu'on sache aujourd'hui qu'il n'existe pas de relation directe entre les propriétés olfactives et l'aromaticité chimique. Cette dernière est en effet définie pour un composé organique contenant un système cyclique par la règle d'aromaticité de Hückel : le système cyclique doit être plan et posséder (4n + 2) électrons délocalisés, n étant un entier naturel quelconque. Si le cycle contient des éléments autres que le carbone et l'hydrogène, on parle d'hétérocycle aromatique.
Les composés aromatiques libérés par les fleurs sont les substances les plus communes dans leur parfum[1].
Aromaticité du benzène[modifier | modifier le code]
Le modèle des hydrocarbures aromatiques est le benzène C6H6, constitué d'un cycle à 6 atomes de carbone formant un hexagone régulier et comportant six électrons délocalisés. La représentation de ce système est un hexagone dans lequel trois liaisons doubles alternent avec trois liaisons simples. Les six liaisons sont de longueur identique, intermédiaire entre les longueurs de la simple et de la double liaison.

Le modèle développé par Kékulé pour le benzène consiste en deux formes mésomères, qui correspondent aux liaisons doubles et simples changeant de positions. Une autre représentation est celle de la liaison π au-dessus ou sous l'anneau. Ce modèle représente plus correctement la position de la densité d'électron dans l'anneau aromatique.
Typologie[modifier | modifier le code]
Dérivés du benzène[modifier | modifier le code]
Les composés ci-dessous comportent un seul cycle aromatique à six atomes de carbone :
- le benzène ;
- les hydrocarbures aromatiques monocycliques, parfois nommés alkylbenzènes : toluène, xylènes, éthylbenzène, cumène, styrène, mésitylène, etc. ;
- le phénol et les composés phénolés ;
- l'aniline et les amines aromatiques monocycliques, comme la p-phénylènediamine ;
- l'acide benzoïque ;
- le chlorobenzène ;
- le nitrobenzène ;
- l'acide salicylique et l'acide acétylsalicylique (aspirine) ;
- le paracétamol ;
- l'acide picrique ;
- le trinitrotoluène ;
- la phénacétine.
Hétérocycles aromatiques[modifier | modifier le code]
Les hétérocycles sont une classe de composés dans lesquels un ou plusieurs atomes de carbone d'un composé cyclique est remplacé par un élément dit hétérogène comme l'oxygène, l'azote, le phosphore, le soufre, etc. Les hétérocycles les plus courants contiennent un atome d'azote ou d'oxygène, par exemple :
- la pyridine
- le furane
- le thiophène
- le pyrrole
- la porphyrine
- la chlorine
- l'indole
- le benzofurane
- la quinoléine
- l'isoquinoléine
Les petits systèmes hétérocycliques aromatiques sont le borirène et la forme cationique de l'aziridine.
Aromatiques polycycliques[modifier | modifier le code]
- Le naphtalène C10H8 (2 cycles accolés)
- L'anthracène C14H10 (3 cycles accolés)
Quelques arènes importants sont appelés HAP, hydrocarbure aromatique polycyclique (PAH en anglais). Ils sont composés de 4 à 7 cycles. Un HAP connu est le benzopyrène qui est très cancérogène. Les HAP forment une vaste famille de composés aux propriétés similaires.
Les HAP existent à l'état naturel dans le pétrole brut : on les appelle les hydrocarbures pétrogéniques. Ils se caractérisent par une forte proportion d'hydrocarbures aromatiques ramifiés, c'est-à-dire substitués par des groupes alkyle. La pyrolyse et la combustion incomplète de matières organiques, comme l'incinération des déchets, la combustion du bois, du charbon, le fonctionnement des moteurs à essence ou des moteurs Diesel produisent aussi des HAP : on les appelle les hydrocarbures pyrogéniques. La combustion des cigarettes produit des HAP et contribue à la présence d'HAPs dans les bâtiments. Ces HAP, liés à l'activité humaine, sont peu ramifiés et ce sont surtout ceux-là qui sont présents dans notre environnement, généralement sous forme de mélanges plus ou moins complexes.
La présence de HAP dans l'environnement est préoccupante, essentiellement à cause de leurs propriétés cancérigènes. C'est tout particulièrement le cas du benzopyrène, du benzoanthracène, du benzofluoranthène, de l'indéno pyrène et du benzopérylène.
La plupart des HAP sont assez résistants à la biodégradation. Cette dégradation se fait dans les couches superficielles du sol, grâce notamment à l'action de certaines bactéries. La majorité des HAP présents dans les eaux de surface ont une origine atmosphérique et, pour la plupart, sont adsorbés sur les sédiments.
Les hydrocarbures aromatiques polycycliques pourraient être présents dans les poussières interstellaires. Ces molécules sont très résistantes aux conditions hostiles existant dans le milieu interstellaire et présentent des spectres en accord avec les raies observées dans les poussières interstellaires, notamment aux longueurs d'onde de 6,2 / 7,7 / 8,3 / 11,3 et 12,8 µm. Formées d'une vingtaine à quelques centaines d'atomes, ces molécules sont nettement plus grandes que les autres molécules détectées dans le milieu interstellaire.
En 1994, Moreels proposa la présence de phénanthrène dans la comète de Halley pour expliquer la raie à 3,28 μm, raie aussi observée dans plusieurs autres comètes[2].
Références[modifier | modifier le code]
- (en) F.P. Schiestl & S. Dötterl, « Feeding-induced rearrangement of green leaf volatiles reduces moth oviposition », Ecology LettersThe evolution of floral scent and insect chemical communication, vol. 13, no 5, , p. 643-656 (DOI 10.1111/j.1461-0248.2010.01451.x).
- Bockelée-Morvan et al., 1995.
