« Liaison carbone-carbone » : différence entre les versions
mAucun résumé des modifications |
mAucun résumé des modifications |
||
| (36 versions intermédiaires par 26 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
Une '''liaison carbone-carbone''' est une [[Liaison chimique|liaison]] [[Liaison covalente|covalente]] entre deux [[atome]]s de [[carbone]]<ref> |
Une '''liaison carbone-carbone''' est une [[Liaison chimique|liaison]] [[Liaison covalente|covalente]] entre deux [[atome]]s de [[carbone]]<ref>March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, [[ISBN]] {{ISBN|0-471-85472-7}}</ref>. La forme la plus courante est la liaison simple qui engage deux [[électron]]s, un de chaque atome. |
||
La liaison simple est une [[ |
La liaison simple est une [[liaison σ]] formée entre les [[Orbitale atomique|orbitales]] [[Orbitale moléculaire|hybridées]] des atomes de carbone. Elle est forcément formée entre deux carbones d'hybridation sp<sup>3</sup> mais peut aussi apparaître entre deux atomes de carbone avec une autre hybridation comme les carbones sp ou sp<sup>2</sup>. |
||
La [[ |
La [[liaison double]] qui apparaît entre carbone sp<sup>2</sup>, est caractéristique des [[alcène]]s et engage quatre électrons. Elle est formée d'une liaison σ et d'une [[liaison π]] issue des orbitales atomiques p<sub>x</sub> ou p<sub>y</sub> non hybridées de chaque atome de carbone. |
||
La |
La [[liaison triple]] qui apparaît entre carbone sp, est caractéristique des [[alcyne]]s et engage six électrons. Elle est formée d'une liaison σ et de deux liaisons π issues des orbitales atomiques p<sub>x</sub> et p<sub>y</sub> non hybridées de chaque atome de carbone. |
||
Le carbone a une caractéristique unique parmi tous les éléments qui est de former de longues chaînes de ses propres atomes, une propriété appelée |
Le carbone a une caractéristique unique parmi tous les éléments qui est de former de longues chaînes de ses propres atomes, une propriété appelée [[caténation]]. Cette propriété couplée à la force des liaisons carbone-carbone permet l'existence d'un nombre gigantesque de formes moléculaires dont beaucoup ont un rôle essentiel dans les processus vitaux. Ainsi, la chimie du carbone a son propre champ de recherche, la [[chimie organique]]. |
||
| ⚫ | |||
| ⚫ | |||
* '''carbone primaire''': un atome de carbones voisin. |
|||
* '''carbone |
* '''[[carbone primaire]]''' : un atome de carbone voisin ; |
||
* '''carbone |
* '''[[carbone secondaire]]''' : deux atomes de carbone voisins ; |
||
* '''carbone |
* '''[[carbone tertiaire]]''' : trois atomes de carbone voisins ; |
||
* '''[[carbone quaternaire]]''' : quatre atomes de carbone voisins. |
|||
:[[ |
: [[Fichier:Substitution du carbone.svg|atomes de carbone primaire, secondaire, tertiaire et quaternaire]] |
||
==Synthèse== |
== Synthèse == |
||
Les réactions de formation de liaisons carbone-carbone sont des réactions organiques dans lesquelles une |
Les réactions de formation de liaisons carbone-carbone sont des réactions organiques dans lesquelles une nouvelle liaison carbone-carbone est créée. Elles sont très importantes dans la production de nombreux composés chimiques synthétiques comme les [[médicament]]s et les [[Matière plastique|plastiques]]. |
||
Quelques exemples de réactions qui forment des liaisons carbone-carbone sont les [[aldolisation|réactions d'aldolisation]], la [[réaction de Diels-Alder]], l'addition d'un [[réactif de Grignard]] sur un groupe [[composé carbonylé|carbonyle]], la [[réaction de Heck]], [[addition de Michael]] ou la [[réaction de Wittig]]. |
Quelques exemples de réactions qui forment des liaisons carbone-carbone sont les [[aldolisation|réactions d'aldolisation]], la [[réaction de Diels-Alder]], l'addition d'un [[réactif de Grignard]] sur un groupe [[composé carbonylé|carbonyle]], la [[réaction de Heck]], [[addition de Michael]] ou la [[réaction de Wittig]]. |
||
== Notes == |
== Notes == |
||
{{Traduction/Référence|en|Carbon–carbon bond|323613828}} |
|||
{{en}} Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en [[anglais]] intitulé « ''[[:en:Carbon-carbon bond|Carbon-carbon bond]]'' ». |
|||
{{Références |
{{Références}} |
||
== Voir aussi == |
|||
| ⚫ | |||
* [[Liaison banane]] |
|||
{{Liaison chimique au carbone}} |
|||
{{Autres projets|wiktionary=liaison carbone-carbone}} |
|||
| ⚫ | |||
[[Catégorie:Chimie organique]] |
|||
| ⚫ | |||
[[en:Carbon-carbon bond]] |
|||
[[es:Enlace carbono-carbono]] |
|||
| ⚫ | |||
[[id:Ikatan karbon-karbon]] |
|||
[[ja:炭素-炭素結合]] |
|||
[[pt:Classificação dos átomos de carbono]] |
|||
Dernière version du 9 juillet 2022 à 22:49
Une liaison carbone-carbone est une liaison covalente entre deux atomes de carbone[1]. La forme la plus courante est la liaison simple qui engage deux électrons, un de chaque atome. La liaison simple est une liaison σ formée entre les orbitales hybridées des atomes de carbone. Elle est forcément formée entre deux carbones d'hybridation sp3 mais peut aussi apparaître entre deux atomes de carbone avec une autre hybridation comme les carbones sp ou sp2. La liaison double qui apparaît entre carbone sp2, est caractéristique des alcènes et engage quatre électrons. Elle est formée d'une liaison σ et d'une liaison π issue des orbitales atomiques px ou py non hybridées de chaque atome de carbone. La liaison triple qui apparaît entre carbone sp, est caractéristique des alcynes et engage six électrons. Elle est formée d'une liaison σ et de deux liaisons π issues des orbitales atomiques px et py non hybridées de chaque atome de carbone.
Le carbone a une caractéristique unique parmi tous les éléments qui est de former de longues chaînes de ses propres atomes, une propriété appelée caténation. Cette propriété couplée à la force des liaisons carbone-carbone permet l'existence d'un nombre gigantesque de formes moléculaires dont beaucoup ont un rôle essentiel dans les processus vitaux. Ainsi, la chimie du carbone a son propre champ de recherche, la chimie organique.
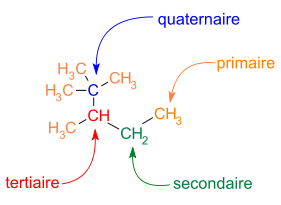
La ramification est aussi commune dans les squelettes carbonés. Les différents atomes de carbone peuvent être identifiés en fonction du nombre de leurs atomes de carbone voisins :
- carbone primaire : un atome de carbone voisin ;
- carbone secondaire : deux atomes de carbone voisins ;
- carbone tertiaire : trois atomes de carbone voisins ;
- carbone quaternaire : quatre atomes de carbone voisins.
Synthèse[modifier | modifier le code]
Les réactions de formation de liaisons carbone-carbone sont des réactions organiques dans lesquelles une nouvelle liaison carbone-carbone est créée. Elles sont très importantes dans la production de nombreux composés chimiques synthétiques comme les médicaments et les plastiques.
Quelques exemples de réactions qui forment des liaisons carbone-carbone sont les réactions d'aldolisation, la réaction de Diels-Alder, l'addition d'un réactif de Grignard sur un groupe carbonyle, la réaction de Heck, addition de Michael ou la réaction de Wittig.
Notes[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carbon–carbon bond » (voir la liste des auteurs).
- March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN (ISBN 0-471-85472-7)
Voir aussi[modifier | modifier le code]
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * |
Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * |
Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |